时间:2020-08-23 07:09:43
1、选择题 R2O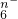 在一定条件下可以把Mn2+氧化成MnO
在一定条件下可以把Mn2+氧化成MnO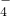 ,若反应后R2O
,若反应后R2O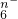 转变为RO
转变为RO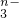 .又知反应中氧化剂与还原剂的物质的量之比为5:2,则n值为
.又知反应中氧化剂与还原剂的物质的量之比为5:2,则n值为
A.1
B.2
C.3
D.4
2、选择题 下列中心原子的杂化轨道类型和分子几何构型不正确的是( )
A.PCl3中P原子sp3杂化,为三角锥形
B.BCl3中B原子sp2杂化,为平面三角形
C.CS2中C原子sp杂化,为直线形
D.H2S分子中,S为sp杂化,为直线形
3、选择题 下列说法正确的是( )
A.热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量。
B.热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据。
C.书写热化学方程式时,不仅要写明反应热的符号和数值,还要注明各物质的聚集状态。
D.凡是化合反应都是放热反应,分解反应都是吸热反应。
4、选择题 下列关于能量的变化及反应热的说法中正确的是 ( )。
A.任何化学反应都有反应热
B.有些化学键断裂时吸收能量,有些化学键断裂时放出能量
C.新化学键的形成不一定放出能量
D.有热量变化的反应一定有化学键的断裂与形成
5、选择题 在相同温度和压强下,将32g硫分别在纯氧和空气中完全燃烧,设前者放热为Q1,后者放热为Q2,则关于Q1和Q2的相对大小正确的是(?)
A.Q1=Q2
B.Q1>Q2
C.Q1<Q2
D.无法判断