时间:2020-08-23 07:02:40
1、选择题 下列有关右图表示的反应叙述正确的是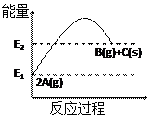
A.1molC(s)的能量高于2molA(g)能量
B.该反应的热化学方程式为:2A(g)=" B(g)+C(s)" △H=(E1-E2)kJ/mol
C.反应过程中当v(A)=0.4mol/(L·s),则v(C)=0.2mol/(L·s)
D.该反应为吸热反应
参考答案:D
本题解析:略
本题难度:简单
2、选择题 下列说法正确的是? ( )。
A.任何化学反应都伴随着能量的变化
B.H2O(g)―→H2O(l)该过程放出大量的热,所以该过程是化学变化
C.化学反应中能量的变化都表现为热量的变化
D.对于如图所示的过程,是吸收能量的过程
参考答案:A
本题解析:任何化学反应都有能量的变化,但有能量变化的过程不一定是化学变化,如物质的三态变化,虽然存在能量变化,但不存在旧化学键的断裂与新化学键的形成,故不是化学变化,所以A项正确,B项错误;化学反应中能量变化的形式有多种,除热能外,还有光能、电能等,C项错误;由图像知,该过程中反应物的总能量大于生成物的总能量,故该过程中放出了能量,D项错误。
本题难度:一般
3、选择题 一种化学冰袋含有Na2SO4?10H2O和NH4NO3,用时将它们混合并用手搓揉就可制冷,且制冷效果能维持一段时间.以下关于其制冷原因的推测中肯定错误的是( )
A.Na2SO4?10H2O脱水是吸热过程
B.较长时间制冷是由于Na2SO4?10H2O脱水过程较慢
C.Na2SO4?10H2O在该条件下发生的复分解反应是吸热反应
D.NH4NO3溶于水会吸收热量
参考答案:A、Na2SO4?10H2O脱水是吸热过程,故A正确;
B、因为十水硫酸钠脱水较慢,它一点点地脱水,水遇上硝酸铵吸热,因此制冷效果可以维持较长,故B正确;
C、Na2SO4?10H2O和NH4NO3不能发生复分解反应,故C错误;
D、硝酸铵夺取硫酸钠结晶水,是一个吸热反应,同时溶解吸热,故D正确;
故选C.
本题解析:
本题难度:简单
4、选择题 反应A(g)+2B(g)=C(g)的反应过程中能量变化如右下图所示。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。下列相关说法正确的是
A.该反应是吸热反应
B.催化剂改变了该反应的焓变
C.催化剂降低了该反应的活化能
D.该反应的焓变△H=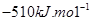
参考答案:C
本题解析:根据图像可知,反应物的能量高于生成物的,因此是放热反应,A不正确;催化剂能降低反应的活化能,但不能改变反应热,因此C正确,B不正确;反应热是419kJ/mol-510kJ/mol=-91kJ/mol,D不正确,答案选C。
本题难度:简单
5、填空题 已知H+(aq)+OH-(aq)=H2O(l)? ΔH=-57.3 kJ·mol-1。回答有关中和反应的问题。
(1)用0.1 mol Ba(OH)2配成稀溶液与足量稀硝酸反应,能放出________kJ热量。
(2)如图装置中仪器A的名称是?,碎泡沫塑料的作用是?。
(3)若通过实验测定中和热的ΔH,其结果常常大于-57.3 kJ·mol-1,其原因可能是?
?。
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会?(填“偏大”、“偏小”、“无影响”)。
参考答案:(1)11.46
(2)环形玻璃搅拌棒;隔热,减少热量散失
(3)实验过程中难免有热量散失(合理答案均可)
(4)偏小
本题解析:(1)由H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ·mol-1可知生成1molH2O放出热量为57.3kJ,而0.1mol Ba(OH)2配成稀溶液与足量稀硝酸反应可得0.2molH2O,所以放出的热量为57.3kJ×0.2=11.46kJ,答案为:11.46;
(2)仪器A的名称是环形玻璃搅拌棒;中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎泡沫塑料的作用是:环形玻璃搅拌棒;隔热,减少热量散失,答案为:环形玻璃搅拌棒;隔热,减少热量散失;
(3)若保温效果不好,有热量散失,求得的中和热数值将会减小,△H大于-57.3kJ·mol-1,答案为:实验过程中难免有热量散失;(合理答案均可)
(4)醋酸为弱酸,电离过程为吸热过程,用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值偏小,故答案为:偏小;
本题难度:简单