时间:2020-08-23 06:48:35
1、选择题 实验室将9 g铝粉跟一定量的金属氧化物粉末混合形成铝热剂。发生铝热反应之后,所得固体中含金属单质为18 g,则该氧化物粉末可能是( )
①Fe2O3和MnO2 ②MnO2和V2O5 ③Cr2O3和V2O5 ④Fe3O4和FeO
A.①②
B.②④
C.①④
D.②③
参考答案:AD
本题解析:①Fe2O3中的铁为+3价,得到1mol电子对应的铁单质的质量为18.7g,MnO2中+4价Mn得到1mol电子对应的锰的质量为13.75g.故①正确;②MnO2中+4价Mn得到1mol电子,对应的锰的质量为13.75g,V2O5中+5价V得到1mol电子对应的质量为10.2g.故②错误;③Cr2O3中+3价的Cr得到1mol电子对应的质量为17.3g,V2O5中+5价V得到1mol电子对应的质量为10.2g.故③错误;④铝全部反应:Fe3O4中的铁为+2和+3价,1个氧离子可失去2个电子,从Fe3O4变成铁.当得到1mol电子时,Fe3O4失去0.5摩尔O,可以得到铁单质168g×0.5/4=21g,FeO中+2价Fe得到1mol电子对应的质量为28g,当铝为部分反应时④仍成立.故④正确;
本题难度:一般
2、选择题 下列各项中表达正确的是(?)
A.F原子结构示意图: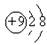
B.H2O的电子式:
C.1H、2H、3H是三种不同元素
D.乙烯的分子式: C2H4
参考答案:D
本题解析:A.F是9号元素,原子核外的电子数与原子核内的质子数相等,所以F原子结构示意图是: 错误;B.H2O是共价化合物,原子间以共价键结合,其电子式是
错误;B.H2O是共价化合物,原子间以共价键结合,其电子式是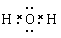 ,错误;C.1H、2H、3H是质子数相同而中子数不同的同一元素的三种不同的原子,错误;D.乙烯的分子式是C2H4 ,正确。
,错误;C.1H、2H、3H是质子数相同而中子数不同的同一元素的三种不同的原子,错误;D.乙烯的分子式是C2H4 ,正确。
本题难度:一般
3、填空题 写出下列化学反应的方程式
(1)实验室制取二氧化碳的反应________________________,
(2)氯气与氢氧化钠反应________________________,
(3)氧化铝跟氢氧化钠溶液的反应(写离子反应方程式)________________________。
(4)漂白粉在空气中漂白原理________________________。
参考答案:(1)CaCO3+2HCl==CO2↑+CaCl2+H2O
(2)Cl2+2NaOH==NaCl+NaClO+H2O
(3)Al2O3+2OH-==2AlO2-+H2O
(4)2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O
本题解析:
本题难度:一般
4、选择题 下列说法不正确的是
A.互为同分异构体的分子结构几乎完全相同
B.丙氨酸CH3-CH(NH2)-COOH存在手性异构体
C.标准状况下,相同体积的NH3 、CH4、HF含有相同的电子数
D.等体积的CO和N2混合后所得的混合气体的平均摩尔质量为28 g/mol
参考答案:A
本题解析:A、互为同分异构体的物质分子式相同,而结构不同。错误。B、在丙氨酸CH3-CH(NH2)-COOH分子中存在一个C原子,它连接了一个—CH3;一个H原子;一个—NH2;一个—COOH,所以含有手性异构体。正确。C、NH3 、CH4、HF都是10个电子的微粒。在标准状况下,相同体积的NH3 、CH4、HF的物质的量相同,所以含有相同的电子数。正确。D、CO和N2的相对分子质量都是28.所以二者无论以任何比例混合所得的混合气体的平均摩尔质量为28 g/mol。正确。
本题难度:一般
5、选择题 工业上冶炼铁有化学方程式如下:Fe2O3+3CO 2Fe+3CO2,在这个氧化还原反应中,氧化剂和还原剂的物质的量之比为( )
2Fe+3CO2,在这个氧化还原反应中,氧化剂和还原剂的物质的量之比为( )
A.3
参考答案:
本题解析:
本题难度:一般