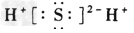时间:2020-08-23 06:48:15
1、选择题 只有在化合物中才能存在的化学键是
[? ]
A.离子键
B.共价键
C.非极性键
D.极性键
2、填空题 (11分)
Ⅰ.(8分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得: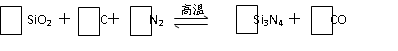
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)若知上述反应每产生2.24LCO气体(折为标准状况)放出Q kJ的热量,则其热化学方程式为? ?
?
(3)用轨道表示式表达Si 核外电子排布情况? ?
?
(4)已知Si的电负性为1.8 ,H的电负性为2.1,N的电负性为3.0 ,则SiH4中硅的化合价为?,Si3N4所属的化合物类型是?(填离子化合物or共价化合物),在前四周期的元素中,未成对电子数最多的元素的电子排布式为?
Ⅱ.(3分)用CH4催化还原NOx可以消除氮氧化物的污染 。例如:
。例如:
CH4(g) +4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
2N2(g)+CO2(g)+2H2O(g)=CH4(g)+4NO(g) ΔH=+1160 kJ·mol-1
若用标准状况下4.48LCH4还原NO2至N2,整个过程中转移的电子总数为 (阿伏伽德罗常数用NA表示),放出的热量为 kJ。
3、简答题 现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 X 最外层电子数是次外层电子数的3倍 Y 常温下单质为双原子分子,其氢化物水溶液呈碱性 Z 第三周期元素的简单离子中半径最小 |
4、选择题 下列关于化学键的说法,正确的是
[? ]
A.任何单质中一定含共价键
B.离子化合物可能含共价键,共价化合物可能含离子键
C.由非金属元素组成的化合物不一定是共价化合物
D.离子键的本质就是阴阳离子间的静电引力
5、选择题 下列电子式书写正确的是
[? ]
A.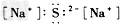
B.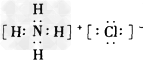
C.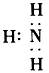
D.