时间:2020-08-23 06:47:33
1、选择题 有Fe2+、NO—3、Fe3+、NH+4、H2O和H+六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是( )
A.氧化剂与还原剂的物质的量之比为8:l
B.若有l mol NO—3参加还原反应,则转移8mol e-
C.还原产物为NH+4
D.若把该反应设计为原电池,则负极反应为Fe2+—e—=Fe3+
参考答案:A
本题解析:Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种微粒属于一个氧化还原反应,Fe3+虽有氧化性,但与H+、NO3-的强氧化性无法比.Fe2+作还原剂,NO3-作氧化剂.由此得出该反应为:8Fe2++NO3-+10H+=8Fe3++NH4++3H2O。A.根据氧化还原反应的规律:升失氧,降得还;若说剂正相反.氧化剂是NO3-,1molNO3-生成1molNH4+,N化合价从+5降为-3,得到8mol电子;还原剂是Fe2+,8molFe2+生成8molFe3+,失去8mol电子.氧化剂与还原剂的物质的量之比为1:8.故A错误;B.根据(氧化剂)降(化合价降低) 得(得到电子) 还(发生还原反应),对应产物为还原产物.NO3-生成NH4+,N化合价从+5降为-3,NH4+为还原产物.故B正确;C.氧化剂是NO3-,1molNO3-生成1molNH4+,N化合价从+5降为-3,得到8mol电子,发生还原反应,被还原,故C正确;D.原电池的负极发生氧化反应.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+,负极反应是Fe2+失去电子,发生氧化反应.故D正确。
考点:本题考查氧化还原反应原理、原电池原理。
本题难度:一般
2、填空题 (4分) 实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下
2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O
(1)在该反应中,还原剂是 。
(2)若在反应中生成了标况下2.24L氯气,则电子转移的个数是 NA。
参考答案:(1)HCl (2)0.2
本题解析:在2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O中,HCl Cl2,化合价升高,失去电子,作还原剂。每产生5摩尔的Cl2转移电子10摩尔。现在产生氯气的物质的量为0.1mol,转移的电子的个数为0.2NA。
Cl2,化合价升高,失去电子,作还原剂。每产生5摩尔的Cl2转移电子10摩尔。现在产生氯气的物质的量为0.1mol,转移的电子的个数为0.2NA。
考点:考查实验室用高锰酸钾和浓盐酸反应制取氯气的氧化剂、还原剂的判断及电子转移的知识。
本题难度:一般
3、填空题 有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
①W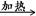 X+H2O+CO2↑
X+H2O+CO2↑
②Z+CO2
参考答案:
本题解析:
本题难度:一般
4、选择题 下列过程是自发进行的吸热反应的使
A.NaOH与HCl 反应
B.CO与O2点燃
C.Ba(OH)2·8H2O与NH4NO3反应
D.SO3与H2O反应
参考答案:C
本题解析:以上四个反应都可自发进行,但A、B、D三个反应都为放热反应,只有C项是吸热反应。
本题难度:简单
5、选择题 分子式为C5H12O的一元醇有多种同分异构体,其中主链上碳原子数为3的同分异构体数目为m,主链上碳原子数目为4的同分异构体数目为n。下列关于m、n的数值正确的是
A.m=1 n=4
B.m=1 n=5
C.m=2 n=5
D.m=2 n=5
参考答案:A
本题解析:该题是对醇类的同分异构体的考查,分子式为C5H12O的一元醇主链上碳原子数为3的同分异构体只有1种:(CH3)3CCH2OH;主链上碳原子数目为4的同分异构体有4种:(CH3)2? CHCH2? CH2OH,(CH3)2? CHCH? OHCH3,(CH3)2? COHCH2? CH3,CH3? CH2? CH(CH3)? CH2OH。
本题难度:简单