时间:2020-08-23 06:45:43
1、简答题 Ⅰ.如图所示是分离混合物时常用的仪器,回答下列问题: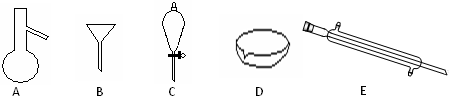
(1)写出仪器A、C、E的名称______
(2)分离以下混合物应该主要选用什么仪器?(填字母符号)
食用油和酒精:______?汽油和水:______
Ⅱ.实验室用固体烧碱配制200mL?0.5mol?L-1的NaOH溶液.
(1)需称量______?g?烧碱,应放在______中称量、溶解.
(2)完成此配制实验,除了量筒,烧杯,玻璃棒外还需要的常见的玻璃仪器有______
(3)请描述定容操作应采取的具体方法______.
参考答案:Ⅰ(1)图中A是蒸馏烧瓶、C是分液漏斗、E是冷凝管,故答案为:蒸馏烧瓶、分液漏斗、冷凝管;
(2)食用油和酒精,互溶,沸点相差较大,可以采取分馏的方法分离,需要用到的仪器为蒸馏烧瓶、冷凝管等,汽油和水为互不相溶的液体,可以利用分液方法分离,需要的仪器为分液漏斗,
故答案为:AE;C;
Ⅱ(1)没有200mL容量瓶,应选择250mL容量瓶,故需要氢氧化钠的质量为0.25L×0.5mol?L-1×40g/mol=5.0g,
氢氧化钠具有腐蚀性、易潮解,应放在烧杯内,迅速称量、溶解,
故答案为:5.0;烧杯;
(2)配制氢氧化钠溶液需要玻璃仪器有烧杯、玻璃棒、250mL容量瓶、胶头滴管等,
故答案为:250mL容量瓶、胶头滴管;
(3)定容操作为:向容量瓶内注入蒸馏水至刻度线1~2cm处,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线正好水平相切,
故答案为:向容量瓶内注入蒸馏水至刻度线1~2cm处,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线正好水平相切.
本题解析:
本题难度:一般
2、选择题 质量分数为a的某物质的溶液m?g与质量分数为b的该物质的溶液n?g混合后,蒸发掉p?g水.得到的溶液每毫升质量为q?g,物质的量浓度为c.则溶质的分子量(相对分子质量)为( )
A.
| q(am+bn) c(m+n-p) |
| c(m+n-p) q(am+bn) |
| 1000q(am+nb) c(m+n-p) |
| c(m+n-p) 1000q(am+bn) |
参考答案:蒸发掉Pg水后溶质质量分数为:ma+nbm+n-p,
根据c=1000ρωM可知,溶质的摩尔质量M=1000ρωc=1000×q×ma+nbm+n-pcg/mol=1000q(am+nb)c(m+n-p)g/mol.
所以溶质的相对分子质量为 1000q(am+nb)c(m+n-p)g/mol.
故选:C.
本题解析:
本题难度:一般
3、实验题 下图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题
(1)该浓盐酸中HCl的物质的量浓度为____________mol·L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_____________。
A、溶液中HCl的物质的量 B、溶液的浓度 C、溶液中Cl-的数目 D、溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500ml 物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取_________ml 上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填序号 A表示“偏大”、填B表示“偏小”、填C表示“无影响”)。
I、用量筒量取浓盐酸进俯视观察凹液面____________
II、定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水____________
参考答案:(1)11.9
(2)BD
(3)16.8;B;B
本题解析:
本题难度:一般
4、选择题 下列各组溶液中,c(Cl-)最大的是( )
A.500mL1mol/LKCl
B.800mL0.5mol/LMgCl2
C.250mL1mol/LFeCl3
D.200mL1mol/LCaCl2
参考答案:A.c(Cl-)=1mol/L;
B.c(Cl-)=0.5mol/L×2=1mol/L;
C.c(Cl-)=1mol/L×3=3mol/L;
D.c(Cl-)=1mol/L×2=2mol/L,
则c(Cl-)最大的是3mol/L,
故选C.
本题解析:
本题难度:一般
5、实验题 有下列化学仪器:①托盘天平,②玻璃棒,③药匙,④烧杯,⑤量筒,⑥容量瓶,⑦胶头滴管,⑧漏斗。
(1)现要配制500mL 1mol·L-1的硫酸溶液,需用质量分数为98%、密度为1.84 g·cm-3的浓硫酸__________________mL。
(2)溶液配制过程中需用的到的仪器是______________ (用编号表示)
(3)容量瓶在使用前需要检验_____________。
(4)下列操作对硫酸的物质的量浓度有何影响(填“偏高”、“偏低”、“不变”)。
①摇匀后发现液面低于刻度线再加水:_________
②容量瓶中原有少量蒸馏水:__________
③定容时俯视观察液面:___________
参考答案:(1)27.2
(2)②④⑤⑥⑦
(3)是否漏水
(4)①偏低;②不变;③偏高
本题解析:
本题难度:一般