时间:2020-08-23 06:43:41
1、选择题 下列关于电解质溶液的叙述中正确的是( )
A.溶质的物质的量浓度相同的NH4Cl和NH4HSO4两种溶液中,c(NH4+)前者大于后者
B.在CH3COONa溶液中c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.Na2CO3、NaHCO3两种盐的溶液中,离子种类相同
D.常温下,某溶液中由水电离出的c(H+)为10-5mol/L,则此溶液可能是盐酸
参考答案:A.硫酸氢铵在水溶液里电离出氢离子,铵根离子水解而使其溶液呈酸性,则氢离子抑制铵根离子水解,所以物质的量浓度相等的氯化铵和硫酸氢铵溶液中,铵根离子浓度硫酸氢铵大于氯化铵,故A错误;
B.醋酸钠是强碱弱酸盐,醋酸根离子水解而使其溶液呈碱性,则c(OH-)>c(H+),溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(Na+)>c(CH3COO-),故B错误;
C.碳酸根离子在水溶液里有两步水解,第一步水解生成碳酸氢根离子,第二步水解生成碳酸,碳酸氢根离子在水溶液里既能电离又能水解,碳酸氢根离子电离生成碳酸根离子,水解生成碳酸,所以两种溶液中离子种类相同,故C正确;
D.酸或碱抑制水电离,含有弱根离子的盐促进水电离,常温下,某溶液中由水电离出的c(H+)为10-5mol/L>10-7mol/L,所以该溶液中的溶质不可能是氯化氢,故D错误;
故选C.
本题解析:
本题难度:一般
2、简答题 运用相关原理,回答下列各小题:
(1)25℃时,某FeCl3溶液的pH=2,则此溶液中由水电离产生的c(OH-)=______;用离子方程式表示FeCl3溶液用于净水的原因:______.
(2)已知NaHSO4在水中的电离方程式NaHSO4=Na++H++SO42-.在NaHSO4溶液中c(H+)______c(OH-)+c(SO42-)(填“>”、“=”或“<”下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH______7.
(3)将等体积的Na2SO4溶液和BaCl2溶液混合,若Na2SO4溶液的浓度为0.02mol/L,则生成BaSO4沉淀所需BaCl2溶液的最小浓度为______.已知Ksp(BaSO4)=1.1×10-10.
(4)分析下表提供的数据:
| 化学式 | 电离常数 HClO Ka=3×10-8 |
| H2CO3 Ka1=4.3×10-7 Ka2=5.6×10-11 |
参考答案:(1)氯化铁是强酸弱碱盐,溶液中氢离子就是水电离出的,水电离出的c(OH-)=c(H+)=10-2mol/L,氯化铁水解生成氢氧化铁胶体,水解方程式为Fe3++3H2O?Fe(OH)3(胶体)+3H+,胶体具有吸附性,能吸附水中的悬浮物,所以能净水;
故答案为:10-2mol/L,Fe3++3H2O?Fe(OH)3(胶体)+3H+;
(2)根据电荷守恒得c(H+)+C(Na+)=c(OH-)+2c(SO42-),根据物料守恒得C(Na+)=c(SO42-),所以c(H+)=c(OH-)+c(SO42-),用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应方程式为NaHSO4+Ba(OH)2=BaSO4↓+H2O+NaOH,混合溶液中的溶质是氢氧化钠,所以溶液呈碱性,溶液的pH>7;
故答案为:=,>;
(3)等体积混合后,c(SO42-)=12×0.02mol/L=0.01mol/L,故BaSO4沉淀所需Ba2+离子的最小浓度为c(Ba2+)=1.1×10-100.01mol/L=1.1×10-8mol/L,故原BaCl2溶液的浓度为2×1.1×10-8mol/L=2.2×10-8mol/L;
故答案为:2.2×10-8mol/L;
(4)①由表中电离平衡常数的数据可知,酸性H2CO3>HClO>HCO3-,根据强酸制备弱酸,84消毒液(有效成分为NaClO)吸收空气中的二氧化碳生成次氯酸与碳酸氢钠,反应离子方程式为:ClO-+H2O+CO2=HClO+HCO3-,生成的次氯酸分解生成盐酸与氧气,反应离子方程式为:2HClO?光照?.?2H++2Cl-+O2↑,导致失效,
故答案为:ClO-+H2O+CO2=HClO+HCO3-,2HClO?光照?.?2H++2Cl-+O2↑;
②等浓度的NaClO、NaHCO3混合溶液中,ClO-与HCO3-水解,溶液呈碱性,所以c(OH-)>c(H+),由于酸性HClO>HCO3-,故HCO3-水解程度更大,故c(ClO-)>c(HCO3-),碳酸氢根和次氯酸根离子的水解是微弱的,所以c(HCO3-)>c(OH-),水和碳酸氢根离子都能电离出氢离子,碳酸根离子只有碳酸氢根离子电离,所以c(H+)>c(CO32-),则各种离子浓度由大到小的顺序:c(Na+)>c(ClO-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);
故答案为:c(Na+)>c(ClO-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
本题解析:
本题难度:一般
3、填空题 有下列四种溶液(均无气体逸出) ?
A.0.01mol/L的H2CO3溶液 ?
B.0.01mol/L的NaHCO3溶液 ?
C.0.02mol/L的HCl与0.04mol/L的NaHCO3溶液等体积混合液 ?
D.0.02mol/L的NaOH与0.02?mol/L的NaHCO3溶液等体积混合液
据此,填写下列空白(填代号)?
(1)?c(H+)?最大的是______________;?
(2)?c(H2CO3)?最大的是______________; ?
(3)?c(HCO3-)?最大的是____________;
(4)?c(CO32-)?最大的是_____________?;
(5)?c(HCO3-)?最小的是____________。
参考答案:(1)A?
(2)D
(3)D
(4)C?
(5)A
本题解析:
本题难度:一般
4、选择题 室温下,向20mL?N?mol?L-1CH3COOH溶液中逐滴加入0.1mol?L-1?NaOH溶液,其pH变化曲线如图所示.下列说法中,正确的是( )
A.a点c(CH3COOH)=10-3mol?L-1
B.b点溶液中离子浓度大小满足关系:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.c点溶液中离子浓度大小满足关系:c(Na+)+c(OH-)=c(H+)+c(CH3COO-)
D.滴定过程中不可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)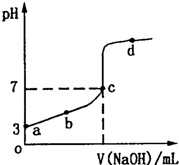
参考答案:A.a点是c(H+)=10-3mol/L,由于醋酸为弱酸,不能完全电离,则c(CH3COOH)>10-3mol?L-1,故A错误;
B.溶液满足c(Na+)+c(H+)=c(OH-)+c(CH3COO-),b点时,c(H+)>c(OH-),则有c(CH3COO-)>c(Na+),故B错误;
C.c点时溶液呈中性,c(H+)=c(OH-),根据溶液电中性原则,存在c(Na+)+c(H+)=c(OH-)+c(CH3COO-),则有
c(Na+)+c(OH-)=c(H+)+c(CH3COO-),故C正确;
D.当醋酸过量,且加入NaOH很少时,则满足c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-),故D错误.
故选C.
本题解析:
本题难度:一般
5、选择题 25℃时,向10ml0.01mol/LKOH溶液中滴加0.01mol/L苯酚溶液,混合溶液中粒子浓度关系正确的
[? ]
A.pH>7时,c(C6H5O-)>c(K+)>c(H+)>c(OH-)
B.pH<7时,c(K+)>c(C6H5O-)>c(H+)>c(OH-)
C.V[C6H5OH(aq)]=10ml时,c(K+)=c(C6H5O-)>c(OH-)=c(H+)
D.V[C6H5OH(aq)]=20ml时,c(C6H5O-)+c(C6H5OH)=2c(K+)
参考答案:D
本题解析:
本题难度:一般