时间:2020-08-23 06:41:57
1、选择题 下列物质中既有配位键,又有离子键,还有共价键的是( )
A.NH4NO3
B.SiO2
C.冰
D.O2
2、选择题 下列分子中,所有原子的最外层均为8电子结构的是(?)。
A.BeCl2
B.H2S
C.NCl3
D.PCl5
3、选择题 下列各图所表示的反应是吸热反应的是( )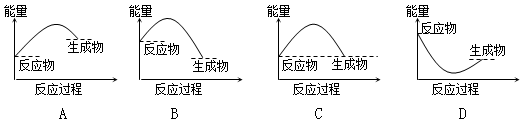
4、填空题 (共4分)合成尿素的反应是分作两步进行的:
①2CO2(g)+ NH3(g) H2NCOONH4(aq)(氨基甲酸铵) △H =-159.47kJ/mol
H2NCOONH4(aq)(氨基甲酸铵) △H =-159.47kJ/mol
②H2NCOONH4(aq) CO(NH2)2(aq)+ H2O(l) △H =-28.49kJ/mol
CO(NH2)2(aq)+ H2O(l) △H =-28.49kJ/mol
在生产条件下,单位时间内获得尿素的产量与压强和n(NH3):n(CO2)的关系如图所示。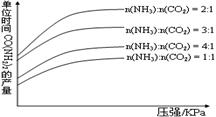
生产过程中n(NH3):n(CO2)的最佳配比为 ,而实际实际生产条件下,往往使n(NH3):n(CO2)≥3,这是因为 。在得到的尿素溶液中会含有少量的氨基甲酸铵,除去这种杂质最简便的方法是 。
5、计算题 人民网曾报道,日本事业集团在太空建立巨大的集光装置,把太阳光变为激光用于分解海水制氢: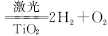 ,下列说法中不正确的是
,下列说法中不正确的是
A.反应物H2O的总能量高于生成物H2和O2的总能量
B.TiO2可以提高H2O的分解率
C.反应为吸热反应
D.使用氢气作燃料有利于控制温室效应