时间:2020-08-23 06:24:57
1、选择题 (7分) t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则:
(1)该温度下,水的离子积常数kw= 。
(2)在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH= 。
3)该温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是 。
(4)该温度下,pH=2的某酸HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。试分析其原因 。
参考答案:(1)10-12 (2)11 (3)a+b = 14
(4)HA为弱酸,使c(HA)>c(NaOH),反应后溶液呈酸性
本题解析:(1)稀溶液中氢离子和OH-的浓度之积是水的离子积,所以kw=c(H+)·c(OH-)=10-a·10-b=10-a-b=10-12。
(2)根据数据可判断氢氧化钠是过量的,所以反应后c(OH-)= 则c(H+)=
则c(H+)= ,所以pH=11。
,所以pH=11。
(3)混合后溶液呈中性,则氢离子的物质的量和OH-的物质的量相等,即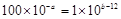 ,解得a+b=14。
,解得a+b=14。
(4)若HA是强酸,则二者恰好反应,溶液显中性。混合溶液的pH=5,说明溶液显酸性,因此HA一定是弱酸,即反应后HA是过量的,所以溶液才能显酸性。
本题难度:一般
2、选择题 下列操作会使H2O的电离平衡向电离方向移动且pH<7的是( )
A.向水中加少量Na2CO3
B.向水中加少量FeCl3
C.向水中加少量NaHSO4
D.向水中加入少量NaCl
参考答案:B
本题解析:
本题难度:简单
3、选择题 下列说法正确的是
A.水的电离过程是吸热过程,升高温度,水的离子积增大、pH减小
B.根据CO2通入漂白粉水溶液中,溶液先变浑浊后澄清,推断SO2通入也有同样现象
C.向1 mL浓度均为0.05 mol·L-1的NaCl、NaI混合溶液中滴加2滴0.01 mol·L-1的AgNO3溶液,振荡,沉淀呈黄色。结论:Ksp(AgCl)<Ksp(AgI)
D.将Fe(NO3)2晶体溶于稀硫酸,滴加KSCN溶液,通过观察溶液变红确定硝酸亚铁晶体已被氧化
参考答案:A
本题解析:A项水的电离过程为吸热过程,升高温度促进水的电离,水的离子积增大,pH减小;B项CO2通入漂白粉水溶液中发生反应:CO2+Ca(ClO)2+H2O=CaCO3+CO2↑+H2O,继续通入又会发生反应:CaCO3+CO2+H2O=Ca(HCO3)2↓,溶液又变澄清;C项同类型的难溶化合物,Ksp越小越容易生成,所以:Ksp(AgCl)>Ksp(AgI);D项溶液中含有H+ 、NO3-,也容易将Fe2+氧化为Fe3+,所以结论错误。
考点:水的电离、溶度积、物质的性质。
本题难度:一般
4、选择题 在纯水中存在如下平衡:2H2O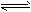 H3O++OH-,若使水的电离平衡向逆反应方向移动,且使溶液中的
H3O++OH-,若使水的电离平衡向逆反应方向移动,且使溶液中的
c(OH-)减小,下列条件能达到的是
[? ]
参考答案:BD
本题解析:
本题难度:一般
5、选择题 下列化学反应中,离子方程式表示正确的是( )
A.少量金属钠加到冷水中:Na+2H2O═Na++OH-+H2↑
B.铁粉加到盐酸中:Fe+2H+═Fe2++H2↑
C.石灰石溶解在稀HCl中:CO32-+2H+═CO2↑+H2O
D.硫酸溶液与氢氧化钡溶液混合:Ba2++OH-+SO42-+H+═H2O+BaSO4↓
参考答案:B
本题解析:
本题难度:简单