时间:2020-08-23 06:03:19
1、选择题 下列溶液中微粒浓度关系一定正确的是( )
A.常温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+)
B.常温下,pH=2的一元酸和pH=12的一元强碱等体积混合: c(OH-)=c(H+)
C.0.1 mol·L—1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)
D.0.1 mol·L—1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
参考答案:C
本题解析:A、氨水与氯化铵混合溶液中的电荷守恒式为:c(NH4+)+c(H+)= c(Cl-)+ c(OH-),常温下, pH=7溶液呈中性,c(OH-)=c(H+),则c(Cl-)=c(NH4+),错误;B、常温下,pH=2的一元强酸和pH=12的一元强碱等体积混合: c(OH-)=c(H+),常温下,pH=2的一元弱酸和pH=12的一元强碱等体积混合: c(OH-)<c(H+),错误;C、0.1 mol·L—1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+),正确;D、硫化钠溶液中质子守恒式为:c(OH-)=c(H+)+c(HS-)+2c(H2S),错误。
考点:考查电解质溶液中离子浓度关系。
本题难度:一般
2、选择题 现有常温下pH=3的醋酸和pH=3的硫酸两种溶液,下列叙述正确的是?
[? ]
A.两溶液中由水电离出的c(H+)均为1×10-11mol/L
B.加水稀释100倍后两溶液的pH仍相同
C.醋酸中的c(CH3COO-)和硫酸中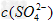 的相等
的相等
D.等体积的两溶液中分别加入足量锌片时放出H2的体积相同
参考答案:A
本题解析:
本题难度:一般
3、选择题 有甲、乙两醋酸稀溶液,测得甲的pH=2,乙的pH=3,下列推断中正确的是
[? ]
A.物质的量浓度c(甲)=c(乙)
B.甲中由水电离产生的H+的物质的量浓度是乙的0.1倍
C.中和等物质的量浓度等体积的NaOH溶液需甲、乙两酸的体积V(乙)=10V(甲)
D.甲中的c(OH-)为乙中c(OH-)的10倍
参考答案:B
本题解析:
本题难度:一般
4、选择题 不能说明CH3COOH是弱酸的事实是
A.醋酸钠溶液显碱性
B.10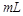
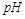 =2的醋酸溶液加水稀释到100
=2的醋酸溶液加水稀释到100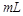
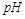
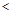 3
3
C.中和10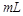 0.1
0.1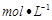 醋酸溶液,需要消耗0.1
醋酸溶液,需要消耗0.1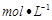 氢氧化钠溶液10
氢氧化钠溶液10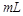
D.0.1 mol·L-1的醋酸溶液中,氢离子浓度约为0.001 mol·L-1
参考答案:C
本题解析:弱电解质的证明,是基于与强电解质对比进行的。弱电解质与强电解质最大的区别就是弱电解质存在电离平衡,而强电解质不存在电离平衡。因此只要证明有电离平衡存在,就证明了弱电解质。所以选项ABD均可以证明醋酸存在电离平衡。C中任何一元酸均消耗等量的氢氧化钠,不能证明,答案选C。
点评:该题是高考中的常见题型,试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,旨在培养学生的逻辑推理能力和抽象思维能力,提高学生的应试能力,调动学生的学习兴趣。该题的关键是明确弱电解质的电离平衡特点,然后灵活运用即可。
本题难度:一般
5、选择题 在相同温度下,100mL?0.1mol-L-1的醋酸与10mL?1mol-L-1的醋酸相比较,下列说法正确的是( )
A.发生中和反应时所需NaOH的量前者大于后者
B.前者的电离程度小于后者
C.溶液中H+的物质的量前者大于后者
D.溶液中CH3COOH的物质的量前者大于后者
参考答案:C
本题解析:
本题难度:简单