时间:2020-08-23 05:59:52
1、选择题 25℃时,在25 mL 0.1 mol·L-1的NaOH溶液中,逐滴加入0.2 mol·Lˉ1的CH3COOH溶液。溶液pH的变化曲线如图所示。下列分析的结论中,不正确的是
A、C点时c(CH3COO-)>c(Na+)>c(H+)>c(OH—)
B、D点时c(CH3COO-)+c(CH3COOH)=2c(Na+)
C、曲线上A、B间任一点,溶液中都有:c(Na+)>c(CH3COOˉ)>c(OH-)>c(H+)
D、B点的横坐标a=12.5ml
参考答案:CD
本题解析:
A、C点时,醋酸的量相对于氢氧化钠过量,溶液的组成为醋酸和醋酸钠的混合物,溶液显酸性,c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故A正确;
B、在D点时,反应后醋酸剩余,溶液的组成为等浓度的醋酸和醋酸钠的混合物,根据物料守恒,此时:c(CH3COO-)+c(CH3COOH)=2c(Na+),故B正确;
C、在AB区间内,溶液显碱性,c(OH-)>c(H+),当氢氧化钠溶液和醋酸恰好反应是时,显碱性,此时生成的溶液可能为醋酸钠,c(OH-)<c(CH3COO-);当氢氧化钠溶液和醋酸反应后剩余氢氧化钠溶液,溶液仍然显碱性,此时若剩余的氢氧化钠量很大,则c(OH-)>c(CH3COO-),也有可能剩余的氢氧化钠和醋酸钠中醋酸根水解之后剩余的醋酸根的浓度相等,故C不正确;
D、若a=12.5,醋酸和氢氧化钠的物质的量之比为1:1,反应后溶液的组成为醋酸钠,CH3COONa为强碱弱酸盐,溶液显碱性,pH>7,介于AB之间,故D不正确。
考点:考查弱电解质、盐类水解以及酸碱滴定曲线的分析
点评:本题考查了弱电解质、盐类水解以及酸碱滴定曲线的分析,难度较大。本题解题的关键是明确酸碱反应时二者的比例关系,以及醋酸量的多少对溶液酸碱性的影响。
本题难度:困难
2、填空题 (1)25℃时,pH=12.0的KOH溶液中,由水电离出的C(OH-)=_______mol/L;pH=12.0的K2CO3溶液中,由水电离出来的C(OH-)=_______mol/L。
(2)常温下0.1mol·L-1 CH3COONa溶液PH=8
①用离子方程式表示CH3COONa溶液PH=8的原因:
②按物质的量浓度由大到小顺序排列该溶液中各种微粒(水分子除外)
(3)FeCl3的水溶液呈 (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示): , 实验室在配制FeCl3的溶液时,常将FeCl 3固体先溶于 中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解,否则得到的是浑浊的溶液。
参考答案:(1)1×10-12 1×10-2
(2)CH3COO-+H2O CH3COOH+OH- c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
CH3COOH+OH- c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
(3)酸性 Fe3++3H2O  Fe(OH)3+3H+ HCl 抑制
Fe(OH)3+3H+ HCl 抑制
本题解析:(1)抑制水电离,含有弱根离子的盐促进水电离,碱溶液中水电离出的c(OH-)=c(H+)=10-12 mol/L,K2CO3是强碱弱酸盐,促进水电离,溶液中水电离出的c(OH-) 为水的离子积常数与c(H+)的比,所以水电离出来的c(OH-)=10?14/10?12mol/L=10-2 mol/L。(2)①醋酸钠中醋酸根离子能水解,导致溶液显示碱性,即CH3COO-+H2O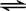 CH3COOH+OH- ,②按物质的量浓度由大到小顺序排列该溶液中各种微粒为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-);(3)FeCl3的水溶液中,由于三价铁离子的水解,导致溶液呈酸性,Fe3++3H2O
CH3COOH+OH- ,②按物质的量浓度由大到小顺序排列该溶液中各种微粒为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-);(3)FeCl3的水溶液中,由于三价铁离子的水解,导致溶液呈酸性,Fe3++3H2O  Fe(OH)3+3H+ ,将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,这样盐酸可以抑制三价铁离子水解;
Fe(OH)3+3H+ ,将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,这样盐酸可以抑制三价铁离子水解;
考点:离子积常数;溶液pH的定义;铁的化学性质。
本题难度:困难
3、填空题 (16分)物质在水溶液中可能存在电离平衡、盐的水解平衡
(1)有0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为
。
(2)有0.1 mol·L-1的NaHCO3溶液,在该溶液中存在的平衡有三个,请分别用离子方程式表示:
_________________
。
(3)NH3·H2O 的电离方程式是 ,往氨水中加入少量醋酸铵固体(提示醋酸铵呈中性),C(OH-) (填“增大”“减小”“不变”)。
(4)已知某温度下K(NH3·H2O)=1.69×10-5,则该温度下0.1mol/L的氨水中C(OH-)= mol/L
(5)若将等pH、等体积的②NaOH溶液和⑦NH3·H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m________(填“<”、“>”或“=”)n。
参考答案:(1)c(NH4+)>c(SO42-)>c(H+)>c(OH-)
(2)HCO3-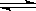 H+ +CO32- HCO3-+H2O
H+ +CO32- HCO3-+H2O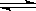 H2CO3+OH- H20
H2CO3+OH- H20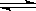 H+ +OH-
H+ +OH-
(3)NH3.H2O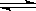 NH4+ + OH- 减小
NH4+ + OH- 减小
(4) 1.3×10-3
(5)<
本题解析:(1) (NH4)2SO4水解,溶液呈酸性,所以c(NH4+)>c(SO42-)>c(H+)>c(OH-);(2)NaHCO3溶液中,存在HCO3-的水解,HCO3-+H2O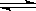 H2CO3+OH-;HCO3-的电离,)HCO3-
H2CO3+OH-;HCO3-的电离,)HCO3-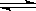 H+ +CO32-;水的电离H20
H+ +CO32-;水的电离H20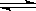 H+ +OH-;(3)NH3·H2O 为弱电解质,电离方程式是NH3.H2O
H+ +OH-;(3)NH3·H2O 为弱电解质,电离方程式是NH3.H2O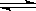 NH4+ + OH-;铵根离子浓度增大,NH3.H2O
NH4+ + OH-;铵根离子浓度增大,NH3.H2O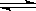 NH4+ + OH-电离平衡左移,c(OH-)减小;(4) K(NH3·H2O)=1.69×10-5,所以
NH4+ + OH-电离平衡左移,c(OH-)减小;(4) K(NH3·H2O)=1.69×10-5,所以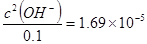 ,所以c(OH-)=1.3×10-3mol/L;(5)弱电解质稀释相同倍数,PH变化小,故m<n。
,所以c(OH-)=1.3×10-3mol/L;(5)弱电解质稀释相同倍数,PH变化小,故m<n。
考点:本题考查弱电解质电离和盐的水解。
本题难度:困难
4、选择题 某碱性溶液中只有NH4+、Cl-、H+、OH-四种离子。则下列描述正确的是
A.该溶液可由等物质的量浓度、等体积的氨水溶液和盐酸溶液混合而成
B.该溶液可由pH=2的HCl与pH=12的氨水等体积混合而成
C.加入适量的盐酸,溶液中离子浓度为c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.加入适量CH3COOH溶液,c(NH4+)一定大于c(Cl-)、c(CH3COO-)之和
参考答案:B
本题解析:A、等物质的量浓度、等体积的盐酸和氨水混合,恰好生成NH4Cl,为强酸弱碱盐,溶液呈酸性,A错误;B、pH=2的盐酸与pH=12的氨水等体积混合,氨水过量,溶液呈碱性,B正确;C、若c(Cl-)>c(NH4+)>c(OH-)>c(H+),溶液电荷不守恒,如c(H+)>c(OH-),应有c(C1-)>c(NH4+),或c(OH-)>c(H+),应有c(NH4+)>c(C1-),C错误;D、加入适量CH3COOH溶液,电荷守恒:c(NH4+)+ c(H+)= c(OH-)+ c(C1-)+ c(CH3COO-),若加入后溶液显酸性,c(H+)>c(OH-),应有c(NH4+)小于c(Cl-)、c(CH3COO-)之和,D错误;答案选B。
考点:考查弱电解质溶液中离子浓度大小比较。
本题难度:一般
5、填空题 按要求完成下列化学反应式
(1)硫酸氢钠在水溶液中的电离方程式 ;
(2)Na2CO3溶液水解的离子方程式 ;
(3)Al2(SO4)3溶液与NaHCO3溶液混合反应的离子方程式 ;
(4)Mg3N2与水反应的化学方程式 ;
参考答案:(1) NaHSO4 = Na+ + H+ + SO42-
(2)CO32-+H2O HCO3-+OH-;HCO3-+H2O
HCO3-+OH-;HCO3-+H2O H2CO3+OH- ;
H2CO3+OH- ;
(3)Al3++3HCO3-=Al(OH)3↓+3CO2 ↑ ;
(4)Mg3N2+6H2O=3Mg(OH)2+2NH3↑;
本题解析:(1)硫酸氢钠为强酸酸式盐,电离产生Na+、H+、SO42?,可得电离方程式。
(2)CO32?分步水解:CO32-+H2O HCO3-+OH-;HCO3-+H2O
HCO3-+OH-;HCO3-+H2O H2CO3+OH-。
H2CO3+OH-。
(3)Al3+与HCO3?发生相互促进的水解反应:Al3++3HCO3-=Al(OH)3↓+3CO2 ↑。
(4)氮化镁与水反应生成氢氧化镁和氨气:Mg3N2+6H2O=3Mg(OH)2+2NH3↑。
考点:本题考查
本题难度:一般