时间:2020-08-23 05:56:25
1、填空题 已知某溶液中只存在OH-、H+、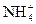 和Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
和Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Cl-)>c(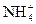 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
②c(Cl-)>c(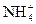 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
③c(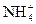 )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(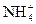 )>c(OH-)
)>c(OH-)
填写下列空白。
(1)若溶液中只溶解了一种溶质,则该溶质是____________,上述四种离子浓度的大小顺序为_________________(填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为____________,若上述关系中④是正确的,则溶液中的溶质为____________________。
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)_________c(NH3·H2O)(填“大于”“小于”或“等于”,下同),混合前酸中c(H+)与碱中c(OH-)的关系是__________________。
参考答案:(1)NH4Cl①(2)NH3和NH4ClNH4Cl和HCl(3)小于大于
本题解析:(1)只能是NH4Cl溶液,其水解后,溶液显酸性。
(2)③由于溶液呈碱性,且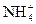 多于Cl-,说明有NH3·H2O;④H+多于
多于Cl-,说明有NH3·H2O;④H+多于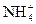 ,说明溶有过量的盐酸。
,说明溶有过量的盐酸。
(3)若盐酸与氨水浓度相同,则最终为NH4Cl溶液,呈酸性,现溶液呈中性,故盐酸浓度较小。若c酸(H+)=c碱(OH-)(此时,pH之和为14),则混合后呈碱性,现呈中性,开始时c酸(H+)>c碱(OH-)。
本题难度:简单
2、选择题 在0.1mol/L的NH4HSO4溶液中,下列微粒的物质的量浓度关系正确的是
A.c(H+) = c(SO42-) > c(NH4+)
B.c(NH4+) + c(H+) =" 2" c(SO42-) + c(OH-)
C.c(H+) = c(NH4+) + c(NH3?H2O) + c(OH-)
D.室温下滴加NaOH溶液至中性后:c(Na+) > c(SO42-) > c(NH4+) > c(OH-) = c(H+)
参考答案:BD
本题解析:A、HSO- 4完全电离,NH4+会部分水解产生H+,c(H+) > c(SO42-) > c NH4+),错误;B、根据溶液中电荷守恒,c(NH4+) + c(H+) =" 2" c(SO42-) + c(OH-),正确;C、由电荷守恒,c(NH4+) + c(H+) =" 2" c(SO42-) + c(OH-),物料守恒:c(NH4+) + c(NH3?H2O)= c(SO42-),可知质子守恒为c(H+) = c(NH4+) + 2c(NH3?H2O) + c(OH-),错误;D、若两者1:1反应得到等浓度硫酸铵和硫酸钠混合溶液,NH4+会部分水解产生H+,此时c(Na+) > c(SO42-) > c(NH4+) > c(H+)>c(OH-),若要显中性,需再滴加NaOH溶液,故c(Na+) > c(SO42-) > c(NH4+) > c(OH-) = c(H+),正确。
本题难度:一般
3、选择题 常温下,关于下列各溶液的叙述正确的是
A.pH=7的醋酸钠和醋酸的混合溶液中:c(CH3COO-)>c(Na+)
B.0.1mol/L稀醋酸pH=a,0.01mol/L的稀醋酸pH=b,则a+1=b
C.0.1mol/L的醋酸钠溶液20mL与0.1mol/L的盐酸10mL混合后溶液显酸性:c(CH3COOH)-c(CH3COO-)=2[c(OH-)-c(H+)]
D.已知酸性HF>CH3COOH,pH相等的NaF溶液与CH3COOK溶液中:[c(Na+)-c(F-)] >[c(K+)-c(CH3COO-)]
参考答案:C
本题解析: A、醋酸钠与醋酸混合溶液中电荷守恒式为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),因pH=7,所以c(CH3COO-)=c(Na+),错误;B、醋酸溶液浓度越大,电离度越小,所以a+1>b,错误;C、0.1mol/L的醋酸钠溶液20mL与0.1mol/L的盐酸10mL混合后电荷守恒式为c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(Cl-)、物料守恒式为c(CH3COO-)+c(CH3COOH)=c(Na+)。其中c(Na+)=2c(Cl-),将电荷守恒式乘以2与物料守恒式相加得c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-),正确;D、NaF和CH3COOK溶液中电荷守恒式分别为c(Na+)+c(H+)=c(F-)+c(OH-)、c(K+)+c(H+)=c(CH3COO-)+c(OH-),因两溶液pH相等,所以c(H+)和c(OH-)分别相等,所以[c(Na+)-c(F-)]=[c(K+)-c(CH3COO-)],错误。
本题难度:困难
4、选择题 某温度下,0.1 mol·L-1 NaHCO3溶液pH=10,下列判断正确的是( )。
A.c(OH-)=10-4 mol·L-1
B.加入少量NaOH固体,c(Na+)和c(HCO3—)均增大
C.c(Na+)+c(H+)=c(HCO3—)+c(OH-)
D.c(Na+)=c(HCO3—)+c(CO32—)+c(H2CO3)
参考答案:D
本题解析:由于没有明确温度,水的电离常数KW可能不是10-14,故c(OH-)不一定为10-4 mol·L-1,故A错误;加入NaOH固体,促进HCO3—电离,c(HCO3—)减小,故B错误;溶液中c(Na+)+c(H+)=c(HCO3—)+c(OH-)+2c(CO32—),故C错误;D项满足物料守恒,故D正确。
本题难度:一般
5、选择题
A.生成了一种强酸弱碱盐
B.弱酸溶液和强碱溶液反应
C.弱酸溶液和弱碱溶液反应
D.一元强酸溶液和一元强碱溶液反应
参考答案:B
本题解析:酸和碱溶液混合后所得溶液呈酸性,其原因有下列两种可能:(1)两种溶液恰好完全反应,但参与反应的是弱碱和强酸,生成强酸弱碱盐容易水解而显酸性。(2)酸和碱并没有恰好完全反应,反应以后酸有剩余,因而溶液显酸性。本题中的酸溶液H+离子浓度只有1×10-3 mol·L-1。如果此酸是强酸,它是完全电离的,可见它是一种稀溶液;如果是弱酸,因为它只有少部分电离,则弱酸的浓度可能较大。选项B是符合条件的答案,混合后的溶液呈酸性这表明所用的是较浓的弱酸实际上是过量的。如果酸是强酸、碱是弱碱,按前分析,两者不可能是等浓度的,可判断选项C不对。也正是由于这种原因。
本题难度:简单