时间:2020-08-23 05:56:04
1、填空题 质能守恒定律包括______________定律和_____________定 律。化学反应中能量变化的主要表现为
___________变化。化学反应中当断裂反应物中的化学键所吸收能量小于形成生成物中的化学键所放出能量时,则反应为_______________反应。当反应物中包含的化学能小于生成物中包含的化学能时,则反应为_____________反应。
参考答案:质量守恒;能量守恒;热能;放出能量(或放热);吸收能量(或吸热)
本题解析:
本题难度:一般
2、选择题 氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,断裂1 mol H2中的化学键消耗
的能量为Q1kJ,断裂1 mol Cl2中的化学键消耗的能量为Q2 kJ,形成1 mol HCl中的化学
键释放的能量为Q3 kJ。下列关系式中一定正确的是
A.Q1+Q2<Q3
B.Q1+Q2>2Q3
C.Q1+Q2=2Q3
D.Q1+Q2<2Q3
参考答案:D
本题解析:氢气在氯气中燃烧是放热反应,△H<0;根据△H=反应物的总键能-生成物的总键能得,
Q1+Q2-2Q3<0,所以Q1+Q2<2Q3,答案选D。
本题难度:一般
3、选择题 下列变化过程属于吸热反应的是(?)
(1) 液氨汽化 (2) 将胆矾加热变为白色粉末 (3) 浓硫酸稀释 (4) 氨催化氧化生成一氧化氮 (5) 酸碱中和生成水? (6) FeCl3溶于水显酸性
A.(1) (2) (6)
B.(1) (2) (4) (6)
C.(2) (5) (6)
D.(2) (4) ( 6)
参考答案:D
本题解析:吸热反应和放热反应都是化学反应,排除(1)(3),这两个是物理过程;剩下(2)、(4)(6)是属于化学反应且为吸热反应,(5)是化学反应但属于放热反应。
本题难度:简单
4、选择题 下列说法正确是( )
A.由H原子形成1molH-H键要吸收热量
B.在稀溶液中,酸与碱发生中和反应生成H2O时所释放的热量称为中和热
C.N2性质非常稳定,是因为N2分子中含有氮氮叁键,要破坏氮氮叁键需吸收更多的能量
D.凡经加热而发生的化学反应都是吸热反应
参考答案:A.化学反应中形成化学键要放热,故A错误;
B.应是强酸和强碱的稀溶液,且生成1mol水放出的热量,故B错误;
C.物质中原子之间的键能越大,越稳定,故C正确;
D.有些放热反应也需加热才能进行,如铝热反应,为放热反应,但需在高温下才能进行,故D错误.
故选C.
本题解析:
本题难度:一般
5、填空题 (12分)下列三个反应在某密闭容器中进行:
反应①? Fe(s)+CO2(g) FeO(s)+CO(g)?△H1=" a" kJ·mol-1
FeO(s)+CO(g)?△H1=" a" kJ·mol-1
反应②? 2CO(g)+O2(g) 2CO2(g)?△H2=" b" kJ·mol-1
2CO2(g)?△H2=" b" kJ·mol-1
反应③? 2Fe(s)+O2(g) 2FeO(s)?△H3
2FeO(s)?△H3
(1)则△H3=?(用含a、b的代数式表示)
(2)已知500℃时反应①的平衡常数K=1.0,在此温度下2L密闭容器中进行反应①,Fe和CO2的起始量均为2.0mol,达到平衡时CO2的转化率为?
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是CO2浓度的两倍,则
a?0(填“>”、“<”或“=”)。为了加快化学反应速率且使体系中CO的物质的量增加,其它条件不变时,可以采取的措施有?(填序号)。
A.缩小反应器体积
B.再通入CO2
C.升高温度
D.使用合适的催化剂
(4)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定——氨的电解法合成,大大提高了氮气和氢气的转化率。总反应式为: 。则在电解法合成氨的过程中,应将H2不断地通入?极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为?。
。则在电解法合成氨的过程中,应将H2不断地通入?极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为?。
(5)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显___________性(填“酸”“碱”或“中”), 可推断a ?0.01(填大于、等于或小于)。
参考答案:(1)(2a+b)kJ·mol-1
(2)50% ?;(3)>(1);BC(4)阳? N2+6H++6e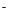 =2NH3)?(5)中,大于。
=2NH3)?(5)中,大于。
本题解析:盖斯定律的应用。反应热也遵守盖斯定律,可以看到
反应③=2①+ ② 所以(1)则△H3=(2a+b)kJ·mol-1
Fe(s)+CO2(g) FeO(s)+CO(g)
FeO(s)+CO(g)
起始物质的量浓度? 1? 1? 0? 0
变化物质的量浓度? x? x? x? x
平衡物质的量浓度? 1-x? 1-x? x? x
已知500℃时反应①的平衡常数K=1.0=x/(1-x)?所以x=0.5?达到平衡时CO2的转化率为100%x/(1-x)=50%
将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是CO2浓度的两倍,平衡向正反应方向移动,说明该反应是吸热反应,则a>0?;为了加快化学反应速率且使体系中CO的物质的量增加,平衡必需向正向移动,而反应前后气体体积不变化,所以可以采取的措施有?
再通入CO2 ;升高温度 ,使用催化剂,只能改变化学反应速率,但是平衡不会移动。 ?从化合价的变化上可以看到氢气的化合价升高,做还原剂,所以在电解法合成氨的过程中,应将H2不断地通入阳极;在另一电极通入N2,该电极反应式为
?从化合价的变化上可以看到氢气的化合价升高,做还原剂,所以在电解法合成氨的过程中,应将H2不断地通入阳极;在另一电极通入N2,该电极反应式为
N2+6H++6e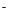 =2NH3?在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),根据质子守恒,知道氢离子和氢氧根的浓度也相等,所以溶液显中性, 可推断a 大于0.01,如实等体积等浓度混合,溶液也会显示酸性,所以显示中性,a 必须大于0.01
=2NH3?在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),根据质子守恒,知道氢离子和氢氧根的浓度也相等,所以溶液显中性, 可推断a 大于0.01,如实等体积等浓度混合,溶液也会显示酸性,所以显示中性,a 必须大于0.01
点评:此题综合性很强,考查知识点广。盖斯定律的内容为:在定压定容条件下,任意一个反应其总反应的热效应只与反应的始态和终态有关而与反应的路程无关。只要学生学习过程中牢记并理解这些基本定义,便不难解答此题。
本题难度:一般