时间:2020-08-23 05:52:15
1、选择题 某元素最高价氧化物对应水化物的分子式是H4RO4,则其氢化物的分子式是
[? ]
A.RH4
B.RH3
C.H2R
D.HR
参考答案:A
本题解析:
本题难度:简单
2、填空题 有A、B、C、D、E五种短周期元素,已知相邻的A、 B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2。E的阳离子与A的阴离子核外电子层结构完全相同。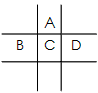
回答下列问题:
(1)五种元素的名称:A______,B______, C______,D______,E______。
(2)B、C、D元素的原子半径由大到小的顺序为__________________________,它们的最高价氧化物对应水化物的酸性强弱顺序为_________________________。
(3)写出C单质在足量A单质中燃烧后的产物与D单质同时通入水中的化学方程式__________________。
(4)A与E形成的化合物的化学式是________,它的性质决定了它在物质的分类中应属于____________。
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量时,观察到的现象是__________________,有关反应的离子方程式为_________________________。
参考答案:(1)?氧;磷;硫;氯;铝
(2)r(P)> r(S)>r(Cl);HClO4>H2SO4>H3PO4
(3)SO2+Cl2+2H2O==H2SO4+2HCl
(4)Al2O3;两性氧化物
(5)有白色沉淀生成,当达到最大量时又逐渐减少,最终沉淀完全消失,变成澄清溶液;
Al3++3OH-==Al(OH)3↓;Al(OH)3+OH-==AlO2-+2H2O
本题解析:
本题难度:困难
3、选择题 在新研制的超导材料中,铊(Tl)是主要组成元素之一.已知铊为ⅢA族原子序数最大的金属元素,则下列关于铊元素性质的推测,不正确的是( )
A.是银白色较软的金属
B.Tl(OH)3与Al(OH)3相似,也是两性氢氧化物
C.可以形成氧化物Tl2O3
D.与酸反应比铝剧烈
参考答案:A.Al为银白色金属,则Tl是银白色较软的金属,故A正确;
B.同主族从上到下金属性在增强,Al(OH)3为两性氢氧化物,则Tl(OH)3为碱性氢氧化物,故B错误;
C.ⅢA族元素的最高价为+3价,则可以形成氧化物Tl2O3,故C正确;
D.同主族从上到下金属性在增强,则Tl与酸反应比铝剧烈,故D正确;
故选B.
本题解析:
本题难度:简单
4、选择题 短周期元素X、Y、Z,其中X、Y位于同一主族,Y、Z位于同一周期.X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比Y原子少1.下列比较正确的是( )
A.气态氢化物的稳定性:Z<Y<X
B.最高价氧化物水化物酸性:Z>Y
C.原子半径:Z<Y<X
D.元素非金属性:Z>Y>X
参考答案:短周期元素X、Y、Z,X原子的最外层电子数是其电子层数的3倍,X原子含有2个电子层,最外层电子数为6,故X为氧元素;X、Y位于同一主族,则Y为硫元素;Y、Z位于同一周期,Z原子的核外电子数比Y原子少1,则Z核外电子数为15,故Z为磷元素.
A、同周期随原子序数增大非金属性增强,所以非金属性P<S,同主族自上而下非金属性减弱,所以非金属性S<O,所以非金属性O>S>P,非金属性越强氢化物越稳定,所以氢化物稳定性Z<Y<X,故A正确;
B、非金属性S>P,非金属性越强最高价氧化物水化物酸性越强,即最高价氧化物水化物酸性Y>Z,故B错误;
C、同周期随原子序数增大原子半径减小,所以原子半径P>S,同主族自上而下原子半径增大,故原子半径S>O,所以原子半径X<Y<Z,故C错误;
D、同周期随原子序数增大非金属性增强,所以非金属性P<S,同主族自上而下非金属性减弱,所以非金属性S<O,所以非金属性X>Y>Z,故D错误.
故选:A.
本题解析:
本题难度:简单
5、推断题 J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。 
(1)元素T在周期表中位于第____族。
(2)M和T形成的化合物在潮湿的空气中形成酸雾,反应的化学方程式为____________________。
(3)L的最简单气态氢化物甲的水溶液显碱性。在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂, 所发生反应的产物不污染环境,其化学方程式为___________________。
参考答案:(1)ⅦA
(2)AlCl3+3H2O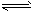 Al(OH)3+3HCl
Al(OH)3+3HCl
(3)2NH3·H2O+3H2O2=N2↑+8H2O
本题解析:
本题难度:一般