时间:2020-08-23 05:50:52
1、选择题 下列各组中化合物的性质比较,不正确的是
A.酸性:HClO4>HBrO4>HIO4
B.稳定性:PH3>H2S>HCl
C.碱性:NaOH>Mg(OH)2>Al(OH)3
D.非金属性:F>O>S
参考答案:B
本题解析:同主族自上而下,非金属性逐渐减弱,最高价氧化物的水化物的酸性逐渐减弱,所以选项A正确;非金属性越强,氢化物的稳定性越强,同周期自左向右,非金属性逐渐增强,选项B不正确,稳定性应该是HCl>H2S>PH3;同周期自左向右,金属性逐渐减弱,最高价氧化物的水化物的碱性逐渐减弱,选项C正确,同意根据元素周期律可知,选项D正确,答案选B。
点评:该题主要是考查学生对元素周期律的熟悉了解程度,以及灵活运用元素周期律解决实际问题的能力,难度不大。该题的关键是熟练记住元素周期律的具体内容,然后结合题意灵活运用即可,有利于培养学生的逻辑思维能力。
本题难度:一般
2、填空题 X、Y、Z三种短周期元素,其中X元素的原子序数大于Y,且X、Y的氧化物都是形成酸雨的主要物质。Z是地壳中含量最高的金属元素;而地壳中含量最高的非金属元素与X同主族、与Y同周期。
(1)实验室用H2XO4制取XO2气体的化学反应方程式为?。(请用具体元素符号表示化学式,下同)
(2)t℃时,0.1 mol·L-1的NaHXO3溶液pH=6,该溶液中各离子浓度由大到小顺序排列为?。
(3)请写出Z的氧化物与烧碱溶液反应的离子方程式?。
(4)一定条件下,YO与YO2存在下列反应:YO(g)+ YO2(g)  Y2O3(g),其平衡常数表达式为K=?。
Y2O3(g),其平衡常数表达式为K=?。
(5)工业上用氧化YH3法制取YO,该反应的热化学方程式为:
4YH3(g)+5O2(g)=4YO(g)+6H2O(g) △H=-905.8kJ·mol-1;
已知Y2(g)+O2(g)=2YO(g)?△H="+180" kJ·mol-1,则YH3与氧气反应产生两种无污染物质的热化学式为?。
参考答案:
(1)Na2SO3+H2SO4=Na2SO4+SO2↑+H2O
〔或2H2SO4(浓)+ Cu  ?CuSO4 + SO2↑+ 2H2O
?CuSO4 + SO2↑+ 2H2O
或2H2SO4(浓)+ S  ?3SO2↑+ 2H2O等合理答案〕(3分)
?3SO2↑+ 2H2O等合理答案〕(3分)
(2)c(Na+)、c(HSO3-)、c(H+)、c(SO32-)、c(OH-)(2分)?
(3)Al2O3+2OH-=2AlO2-+H2O(3分)
(4)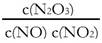 (2分)
(2分)
(5)4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=-1265.8kJ·mol-1(3分)
本题解析:与酸雨有关的两种氧化物为二氧化硫和氮的氧化物,X元素的原子序数大于Y,故XY分别为S和N,Z为Al。(1)实验室中一般用浓硫酸和Na2SO3反应或与铜反应制取二氧化硫;(2)NaHSO3溶液存在HSO3-的电离和水解平衡,根据溶液为酸性,确定以电离为主,故由大到小的顺序为c(Na+)、c(HSO3-)、c(H+)、c(SO32-)、c(OH-);(5)①-②×2得出对应热化学方程式4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=-1265.8kJ·mol-1
本题难度:一般
3、选择题 已知某元素的原子序数,则不能推出该元素原子的
A.质子数
B.中子数
C.电子数
D.核电荷数
参考答案:B
本题解析:在原子中:原子序数质子数=电子数=核电核数。质量数=质子数+中子数,因没有质量数,故无法推出中子数。故选B。
点评:本题考查的是原子核外电子排布的相关知识,题目比较简单,注意基础知识的学习、掌握及应用。
本题难度:简单
4、选择题 科学家对原子结构的认识顺序正确的是
①道尔顿原子模型;②汤姆生原子模型;③卢瑟福原子模型;④电子云模型
A.①③②④
B.④①②③
C.①②③④
D.④②③①
参考答案:C
本题解析:①1803年道尔顿原子模型;②1904年汤姆生原子模型;③1911年卢瑟福原子模型;④1927年德国物理学家海森堡提出了现代电子云模型。
本题难度:一般
5、填空题 (8分)A、B、C是中学化学中常见的三种短周期元素。已知:①A元素原子最外层电子数是次外层电子数的2倍;②B元素最高正价与最低负价的代数和为2;③C元素有多种化合价,且常温下C元素的单质与某种一元强碱溶液反应,可得到两种含C元素的化合物;④B、C两种元素质子数之和是A元素质子数的4倍。
(1)写出常温下C的单质和强碱溶液反应的离子方程式____________________。
(2)意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的B4气态分子。B4分子结构与白磷分子结构相似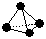 ,已知断裂1 mol B—B键吸收167 kJ的热量,生成1 mol B≡B键放出942 kJ热量。试判断相同条件下B4与B2的稳定性顺序是:______________________。
,已知断裂1 mol B—B键吸收167 kJ的热量,生成1 mol B≡B键放出942 kJ热量。试判断相同条件下B4与B2的稳定性顺序是:______________________。
 (3)由B、C两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形分子,且分子里B、C两种原子最外层均达到8个电子的稳定结构。X遇水蒸气可形成一种常见的漂白性物质。则X与水反应的化学方程式是___________________。
(3)由B、C两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形分子,且分子里B、C两种原子最外层均达到8个电子的稳定结构。X遇水蒸气可形成一种常见的漂白性物质。则X与水反应的化学方程式是___________________。
(4) A、B两种元素可形成一种硬度比金刚石还大的化合物Y。在化合物Y中,A、B原子间以单键相结合,且每个原子的最外层均达到8个电子的稳定结构。则Y的化学式为______________,其熔沸点比金刚石_____(填“高”、“低”或“无法比较”)。
参考答案:
 (共8分) (1 )? C12+2OH-=ClO-+H2O + Cl-?(2分)?
(共8分) (1 )? C12+2OH-=ClO-+H2O + Cl-?(2分)?
(2)N4﹤N2(2分)
(3) NCl3+3H2O=NH3+3HClO (2分)
(4)? C3N4(1分)?高(1分)
本题解析:考查元素周期表的结构及元素周期律的有关应用。
A元素原子最外层电子数是次外层电子数的2倍,则A是C元素;B元素最高正价与最低负价的代数和为2,则B是第ⅤA元素;C元素有多种化合价,且常温下C元素的单质与某种一元强碱溶液反应,可得到两种含C元素的化合物,所以C应该是氯元素;又因为B、C两种元素质子数之和是A元素质子数的4倍,所以B元素是氮元素。
(1)氯气和强碱溶液反应的离子方程式C12+2OH-=ClO-+H2O + Cl-。
(2)断裂1molN4分子中的化学键需要吸收的能量是167 kJ×6=1002kJ。而形成2mol氮气中的化学键所放出的能量是942 kJ×2=1884kJ,这说明N4分子转化为氮气是放热反应,氮气的能量低,因此氮气的稳定性强于N4分子的。
(3)分子里B、C两种原子最外层均达到8个电子的稳定结构,X遇水蒸气可形成一种常见的漂白性物质,所以X的化学式是NCl3,则和水反应的方程式是NCl3+3H2O=NH3+3HClO。
(4)碳元素的最高价是+4价,而氮元素的最低价是-3价。在化合物Y中,A、B原子间以单键相结合,且每个原子的最外层均达到8个电子的稳定结构,所以Y的化学式应该是C3N4。化合物和金刚石相同形成的晶体类型是原子晶体,由于碳原子半径大于氮原子半径,所以金刚石的熔沸点低于C3N4。
本题难度:一般