时间:2020-08-13 07:25:33
1、填空题 已知A、D为单质,B、C为化合物,B溶液中滴加硫氰化钾溶液变红色,A的水溶液能使有色布条褪色。
(1)写出A、C的化学式:A?▲?;C?▲?;
(2)? B与D反应的离子方程式?▲?。
参考答案:(1)A:Cl2? C:FeCl2?
(2)2Fe3++Fe=3Fe2+
本题解析:略
本题难度:简单
2、简答题 常见的无机物之间有如图所示的转化关系,已知,A、B、C、D、G含有同一种元素,E是通常情况下密度最小的气体,B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,B具有氧化性,能将SO2氧化为F(H2SO4),F与A反应生成E和G.相关物质的颜色如下表:
| 物质 | 纯A(单质) | B溶液 | C固体 | D固体 | G溶液 颜色 银白色 黄色 红褐色 红棕色 浅绿色 |
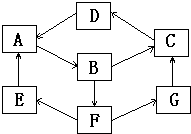
参考答案:E是通常情况下密度最小的气体,E是氢气,B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,说明B中有氯元素,B溶液显黄色,又知B具有氧化性,能将SO2氧化为硫酸,则B是FeCl3,C固体是红褐色,为Fe(OH)3,结合转化关系,红棕色固体D为Fe2O3,则A、B、C、D、G含有同种元素为铁元素,可推知A为Fe,硫酸与铁反应生成E、G,G溶液为浅绿色,所以G为FeSO4,
(1)由上述分析可知,D为Fe2O3FeSO4,E是H2,
故答案为:Fe2O3:H2;
(2)G为硫酸亚铁,加入碱生成白色的氢氧化亚铁,氢氧化亚铁不稳定,易与氧气反应生成红褐色的氢氧化铁沉淀,有关反应方程式为:FeSO4+NaOH=Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:先产生白色沉淀,逐渐变为灰绿色,最后变为红褐色;FeSO4+NaOH=Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)F→E的离子方程式为:Fe+H+=Fe2++H2↑,
B→F的离子方程式为:2Fe3++Fe═3Fe2+,
故答案为:Fe+H+=Fe2++H2↑;2Fe3++Fe═3Fe2+.
本题解析:
本题难度:一般
3、填空题 字母L,M,Q,R,X分别代表五种含不同化合价的氮元素的物质,并且每种物质中氮元素的化合价只有一种。又知道物质L中氮元素化合价比物质M中氮元素化合价低,并且在一定条件下,它们会有如下相互转换关系(方程式未配平):
①Q+HCl→M+Cl2?②R+L→X+H2O?③R+O2→L+H2O
(1)已知这五种物质中有一种是HNO3,那么硝酸应该是_______(填物质字母)。
(2)反应③是存在催化剂(如铂、氧化铁等),并且加热到一定温度时发生的,这个反应在工业上有重要的应用,请据此推断,若物质X的密度比CO2小,那么X的化学式_______。
(3)某同学写出以下三个化学方程式(未配平):
a.NO+HNO3→N2O3+H2O
b.NH3+NO→HNO2+H2O
c.N2O4+H2O→HNO3+HNO2
其中你认为一定不可能实现的是______。
参考答案:(1)Q? (2)N2?(3)b
本题解析:(1)含有同种元素的两种物质发生氧化还原反应,生成物的价态介于两种反应物中该元素价态之间,反之亦然。
由反应①可知价态:Q>M
由反应②可知价态:L>X>R或R>X>L
由反应③可知价态:R<L可以排除R>X>L
又因为L<M(题中告知),则价态关系:Q>M>L>X>R。HNO3中N的化合价最高,故应为Q。
本题难度:一般
4、推断题 下图是各物质的反应关系图:已知A和E都是黄色粉末,A常用为呼吸面具的供氧剂,E在空气中燃烧火焰为淡蓝色,F有刺激性气味且有漂白性常被不法商人用来漂白银耳、腐竹等,H具有很强腐蚀性。请据此回答下列问题: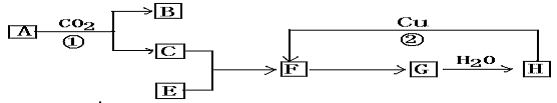
(1) 写出下列各物质的化学式: A.__________? F_________
(2)写出图中编号的化学方程式: ①____________________?②______________
参考答案:(1) A. Na2O2? F.SO2
(2)写出图中编号的化学方程式:
① 2Na2O2+2CO2=2Na2CO3+O2
②Cu+2H2SO4(浓)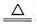 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
本题解析:本题的突破口是物质的颜色和特殊的化学化学反应。A和E都是黄色粉末,A常用为呼吸面具的供氧剂,E在空气中燃烧火焰为淡蓝色,可知A为Na2O,E为S;F有刺激性气味且有漂白性常被不法商人用来漂白银耳、腐竹等,可知F为SO2;H具有很强腐蚀性,可知F为浓H2SO4。
点评:推断题的关键是突破口的选择,颜色,重要的反应都可以作为突破口,同时要敢于尝试,记住重要的化学反应和一些特殊物质的颜色。
本题难度:一般
5、选择题 X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物.下表各组物质之间通过一步反应不能实现如图所示转化的是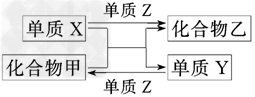
[? ]