时间:2020-08-13 07:24:29
1、选择题 下列物质中,有固定熔、沸点的是
A.天然气
B.石油
C.甲烷
D.汽油
参考答案:C
本题解析:分析:具有固定的熔点、沸点的物质一定是纯净物.
解答:A.天然气是混合物,主要成分是甲烷,故A错误;
B.石油是含多种烃的混合物,故B错误;
C.甲烷只含一种物质是纯净物,有固定熔、沸点,故C正确;
D.汽油主要成分为C4~C12脂肪烃和环烃类,并含少量芳香烃和硫化物,是混合物,故D错误.
故选C.
点评:本题考查纯净物的性质,难度不大,根据物质具有固定的熔点、沸点判断物质为一定是纯净物是解题关键.
本题难度:一般
2、选择题 已知元素的质子数,可以推知原子的:①原子序数②核电荷数③离子所带的电荷数④核外电子数,其中正确的是(?)
A.①②③
B.②③
C.①②
D.①②④
参考答案:D
本题解析:质子数=核电荷数=原子序数=原子的核外电子数
本题难度:一般
3、选择题 下列各组中互为同位素的是
A.O2和O3
B.H2和D2
C.CH4和C3H8
D. 2He和3He
参考答案:D
本题解析:
A、同素异形体;B、同属氢气;C、同系物;D、正确,具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素。2He和3He,中子数分别为0、1.
本题难度:简单
4、选择题 A、B、C是原子序数依次增大的短周期元素,A元素某种同位素原子在考古方面有重要应用,B的最外层电子是电子层数的三倍,C的焰色反应呈黄色,下列说法正确的是
A.元素A在周期表中的位置为第2周期VIA族
B.元素A、B、C的原子半径由大到小的顺序为r(C) > r(B) > r(A)
C.A、B两种元素的氢化物的稳定性A>B
D.1 molC2B2与足量的AB2完全反应转移约6.02 ×1023个电子
参考答案:D
本题解析:根据题意知,A、B、C是原子序数依次增大的短周期元素,A元素某种同位素原子在考古方面有重要应用,则A为碳元素,B的最外层电子是电子层数的三倍,则B为氧元素,C的焰色反应呈黄色,则C为钠元素。A、A为碳元素,在周期表中的位置为第2周期ⅣA族,错误;B、根据微粒半径比较原则判断,元素A、B、C的原子半径由大到小的顺序为r(Na) > r(C)> r(O)即 r(C) > r(A)> r(B),错误;C、同一周期由左向右气态氢化物的稳定性逐渐增强,A、B两种元素的氢化物的稳定性A<B,错误,D、1 molNa2O2与足量的CO2完全反应转移约6.02 ×1023个电子,正确。
本题难度:一般
5、填空题 请按要求填空:
I.现有:①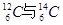 、②O2与O3、③正丁烷与异丁烷、④金刚石与石墨、⑤冰与水、⑥乙醇与二甲醚。请用序号填写对应的分类:(1)互为同位素的是?;(2)互为同素异形体的是?;(3)互为同分异构体的是?;(4)属于同一化合物的是?。
、②O2与O3、③正丁烷与异丁烷、④金刚石与石墨、⑤冰与水、⑥乙醇与二甲醚。请用序号填写对应的分类:(1)互为同位素的是?;(2)互为同素异形体的是?;(3)互为同分异构体的是?;(4)属于同一化合物的是?。
II.现有下列五种物质:①Ar?②CO2?③SiO2?④NaOH?⑤K2S,请按要求用序号填空:
(1)属于离子晶体的是?,属于原子晶体的是?,属于分子晶体的是?;
(2)只含共价键(不含分子间作用力)的是?,只存在离子键的是?,既存在离子键又存在共价键的是?,不存在化学键的是?。
参考答案:I.(1)①;(2)②④;(3)③⑥;(4)⑤
II. (1)④⑤,③,①②;?(2)③,⑤,④,①
本题解析:I、同素异形体,是指由同样的单一化学元素构成,但性质却不相同的单质。同分异构体,是指分子式相同,结构不同的物质。具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素。
II.离子晶体,是指离子间通过离子键结合形成的晶体;原子晶体,是指相邻原子之间通过强烈的共价键结合而成的空间网状结构的晶体;分子晶体,指分子间以范德华力相互结合形成的晶体。(2)原子间通过共用电子对而形成的化学键叫共价键;离子键指阴离子、阳离子间通过静电作用形成的化学键。单原子分子不存在化学键,以分子间作用力结合。
点评:对化学基本概念的考查是高考必考知识点,难度不大,考生在平时的学习过程中应注意基本概念的准确定义和化学用语的规范使用。
本题难度:一般