时间:2020-08-13 07:19:17
1、计算题 (6分)在由Cu片、Zn片和200 mL稀H2SO4组成的原电池中,当Cu片上放出2.24 L(标准状况下)H2时,H2SO4恰好用完。问:
(1)此时在导线上有多少摩尔电子通过??(2)Zn片溶解的质量是多少?
(3)原稀H2SO4的物质的量浓度是多少?
参考答案:(6分)(1)0.2 mol?(2)6.5 g?(3)0.5 mol/L
本题解析:略
本题难度:一般
2、选择题 根据Zn+2H+ Zn2++H2↑的反应原理设计一个原电池,当Zn为负极时,正极可以选用的金属材料是(? )
Zn2++H2↑的反应原理设计一个原电池,当Zn为负极时,正极可以选用的金属材料是(? )
A.镁
B.石墨
C.铝
D.铅
参考答案:D
本题解析:根据原电池的总反应,负极为Zn,正极若为金属,则其金属活动性应比锌弱,所给选项中只有铅符合。故答案为D项。
本题难度:简单
3、选择题 对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是
[? ]
A.Zn是阴极
B.负极上发生还原反应
C.正极发生的反应是 Cu2+ + 2e- === Cu
D.负极发生的反应是 Zn - 2e- === Zn2+?
参考答案:D
本题解析:
本题难度:简单
4、选择题 a、b的活动性均比氢强,a还可以从b的硝酸盐中置换出b.将a、b用导线相连放入CuSO4溶液中,下列叙述中不正确的是( )
A.导线上有电流,电流方向由a到b
B.a极质量减少,b极质量增加
C.b棒上析出氢气
D.a棒发生氧化反应,b棒发生还原反应
参考答案:a、b的活动性均比氢强,a还可以从b的硝酸盐中置换出b,则a的活泼性强与b,将a、b用导线相连放入CuSO4溶液中,会形成原电池,活泼金属a为负极,b为正极.
A、a、b用导线相连放入CuSO4溶液中,会形成原电池,其中a为负极,b为正极,电流从负极b流向正极a,导线上有电流,电流方向由b到a,故A错误;
B、在原电池中,负极a发生失电子的氧化反应,质量减轻,不活泼金属b为正极,发生得电子的还原反应,质量增加或者是产生氢气,故B正确;
C、b为正极,发生得电子的还原反应,质量增加或者是产生氢气,故C正确;
D、在原电池中,负极a发生失电子的氧化反应,b极发生得电子的还原反应,故D正确.
故选A.
本题解析:
本题难度:一般
5、选择题 如图所示,X为铁、Y是石墨电极,a是饱和食盐水,实验开始前,在U形管的两边同时各滴入几滴酚酞试液,下列叙述错误的是( )
A.合上K1、断开K2,该装置可以将化学能转变为电能
B.合上K2、断开K1,一段时间后,湿润的KI淀粉试纸靠近Y电极管口,试纸变蓝
C.合上K1、断开K2,溶液中阴离子向Y电极定向移动
D.合上K2、断开K1,一段时间后,X电极附近溶液呈红色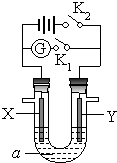
参考答案:A、合上K1、断开K2,该装置是原电池,是把化学能转变为电能的装置,故A正确;
B、合上K2、断开K1,该装置有外接电源,所以是电解池,连接电源正极的Y石墨电极是阳极,阳极上氯离子放电生成氯气,氯气和碘化钾发生置换反应生成碘单质,碘遇淀粉变蓝色,所以一段时间后,湿润的KI淀粉试纸靠近Y电极管口,试纸变蓝,故B正确;
C、合上K1、断开K2,该装置是原电池,较活泼的金属铁X作负极,石墨Y作正极,原电池放电时,溶液中阴离子向负极X移动,故C错误;
D、合上K2、断开K1,该装置有外接电源,所以是电解池,电解池放电时,连接电源负极的电极X是阴极,阴极上氢离子得电子生成氢气,导致X电极附近氢氧根离子浓度增大,溶液碱性增强,所以一段时间后,X电极附近溶液呈红色,故D正确;
故选C.
本题解析:
本题难度:一般