时间:2020-08-13 07:14:15
1、选择题 下列化学反应属于“氮的固定”的是( )
A.氯化铵加热分解产生NH3
B.硝酸工厂用NH3氧化制NO
C.N2与H2合成NH3
D.由NH3和硫酸反应制取硫酸铵
参考答案:C
本题解析:
本题难度:一般
2、选择题 下列有关物质的性质叙述不正确的是
A.臭氧可用于自来水的消毒,是由于臭氧具有强的氧化性
B.纤维素水解后的溶液能与新制氢氧化铜悬浊液反应,说明纤维素是还原性糖
C.工业上生产氨气时可以用分离出氨气的方法提高转化率,是利用氨易液化的性质
D.氧化铝能与氢氧化钠溶液反应,又能与盐酸反应,是因为氧化铝是两性氧化物
参考答案:B
本题解析:分析:A、根据臭氧的性质来分析其用途;
B、根据纤维素及水解产物的性质来分析;
C、根据反应的可逆性及化学平衡移动来分析;
D、利用两性氧化物的概念来分析.
解答:A、因臭氧具有强氧化性,则可用于自来水的消毒,故A正确;
B、纤维素水解后生成葡萄糖,葡萄糖能与新制氢氧化铜悬浊液反应,则葡萄糖是还原性糖,而纤维素不属于还原性糖,故B错误;
C、因合成氨的反应为可逆反应,利用氨易液化的性质,及时分离出氨气,能使化学平衡正向移动,提高转化率,故C正确;
D、因氧化铝属于氧化物,既能与酸反应生成盐和水,又能与碱反应生成盐和水,则属于两性氧化物,故D正确;
故选B.
点评:本题较简单,考查知识点较多,注重了对基础知识的考查,学生明确物质的组成和性质即可解答.
本题难度:困难
3、填空题 合成氨对化学工业和国防工业具有重要意义.
(1)向合成塔中按1:4的物质的量之比充入N2、H2进行氨的合成,图A为T0C时平衡混合物中氨气的体积分数与压强(P)的关系图.
①写出工业上合成氨的化学方程式______.
②图A中氨气的体积分数为15.00%时,H2的转化率=______.
③图B中T=500°C,温度为4500C对应的曲线是______(选填字母“a“或“b”),选择的理由是______
④由图象知,增大压强可提高原料的利用率,从生产实际考虑增大压强需解决的问题是______(写出一条即可).
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:
CH4(g)+H2O
CO(g)+3H2(g);△H=+QkJ/mol(Q>0)
(3)一定温度下,在2L容器中发生上述反应,各物质的物质的量变化如下表
| 时间/min | CH4(mol) | H20(?mol) | CO?(mol) | H2?(mol) 0 0.40 1.00 0 0 5 X1 X2 X3 0.60 7 Y1 Y2 0.20 Y3 10 0.21 0.81 0.19 0.62 |
参考答案:(1)①工业上利用氮气和氢气来合成氨,原理方程式为:N2+3H2催化剂.高温高压2NH3,故答案为:N2+3H2催化剂.高温高压2NH3;
②设N2的转化率为x,则N2+3H2催化剂.高温高压2NH3
初始物质的量:1?4?0
变化的物质的量:x? 3x?2x?
平衡时的物质的量:1-x? 4-3x? 2x
氨气的体积分数为15.00%时,则2x2x+1-x+4-3x=15%
解得x=0.33(mol),所以氢气的转化率=0.33×34×100%≈24.45%,故答案为:24.45%;
③对于反应N2+3H2催化剂.高温高压2NH3,当温度降低时,化学平衡向放热反应方向移动,所以氨气的体积分数增大,对应的曲线是b,
故答案为:b;合成氨的正反应是放热反应,根据勒夏特列原理,其他条件不变,降低温度,化学平衡向放热反应方向移动;
④增大压强可提高原料的利用率,但是设备的耐压程度是有限的,从生产实际考虑增大压强可以研制耐压设备或增大压强的动力、材料的强度等,
故答案为:研制耐压设备(或增大压强的动力、材料的强度等其他合理答案);
(2)①根据一氧化碳和氢气的物质的量的变化情况可以判断,5?7min之间反应是处于平衡状态,前5min平均反应速率v(CH4)=△c△t=0.4mol-0.2mol2L5min=0.02mol?min-1,
故答案为:是;0.02mol?min-1;
②反应在7~10min之间,CO的物质的量减少,加入氢气能让平衡逆向移动,减少一氧化碳的浓度,故答案为:d;
③若保持温度不变,向1L容器中起始充入0.15molCH4、0.45molH2O,再充入0.05molCO、0.15molH2相当于是0.05mol的甲烷和0.05mol的水,即充入甲烷是0.2mol,水是0.5mol,和初始投料0.4mol的甲烷和1.0mol的水是等效的,达到平衡时CH4的体积百分含量相同,故答案为:0.05;0.15.
本题解析:
本题难度:一般
4、选择题 2007年诺贝尔化学奖授予德国化学家GerhardErtl,以表彰他在表面化学领域研究所取得的开拓性成就。某反应在Pt/Al2O3/Ba催化剂表面吸附与解吸作用的机理如图所示(图中HC表示碳氢化合物,mtrate指硝酸盐),该机理研究是指 
[? ]
A.汽车尾气催化转化处理
B.钢铁生锈机理
C.合成氨工业催化氧化机理
D.氢氧燃料电池电极反应机理
参考答案:A
本题解析:
本题难度:简单
5、填空题 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为N2+3H2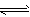 2NH3,则在电化学合成氨的过程中,阳极反应式为________________,阴极反应式为______________。
2NH3,则在电化学合成氨的过程中,阳极反应式为________________,阴极反应式为______________。
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)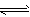 2NH3(g) △H<0,其化学平衡常数K与t的关系如下表:
2NH3(g) △H<0,其化学平衡常数K与t的关系如下表: 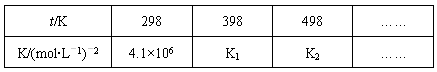
①试确定K1的相对大小,K1____________ 4.1×106(填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是____________ (填序号字母)。
A.容器内N2、H2、NH3的浓度之比为1∶3∶2
B.2v(N2)(正) = v(H2)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
(3)①NH4Cl溶液呈酸性,这是由于NH4+水解的缘故。则NH4Cl溶于重水(D2O)生成一水合氨和水合氢离子的化学式是____________ 。
②某氨水的pH=x,某盐酸的pH=y,x+y=14,且x>11,将上述氨水和盐酸等体积混合后,所得溶液中各种离子的浓度由大到小的顺序为___________
A.[Cl-]>[NH4+]>[H+]>[OH-]
B.[NH4+]>[Cl-]>[OH-]>[H+]
C.[Cl-]>[NH4+]>[OH-]>[H+]
D.[NH4+]>[Cl-]>[H+]>[OH-]
参考答案:(1)3H2→6H++6e-;N2+6H++6e-→2NH3;
(2)<;C
(3)①NH3·HDO和D3D+;②B
本题解析:
本题难度:一般