时间:2020-08-13 07:13:14
1、选择题 通过NOx传感器可监测NOx的含量,其工作原理示意图如下: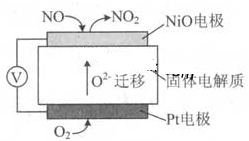
下列说法正确的是 (?)
A.NiO 电极是该电池的正极
B.Pt电极附近的pH 增大
C.NiO 电极的电极反应式:NO—2e—+O2—=NO2
D.固体电解质中O2-向正极移动
参考答案:C
本题解析:A、NiO 电极NO失去电子生成NO2,为负极,错误;B、Pt电极氧气得到电子生成O2-,与酸碱性无关,错误;C、正确;D、原电池中负离子向负极移动,错误。
本题难度:一般
2、选择题 在图所示的原电池中,负极发生的反应是( )
A.Cu2++2e-═Cu
B.Cu-2e-═Cu2+
C.2H++2e-═H2↑
D.Zn-2e-═Zn2+
参考答案:图为铜锌原电池,Zn比Cu活泼,应为原电池的负极,负极反应为Zn-2e-═Zn2+,
正极反应为2H++2e-═H2↑,
故选D.
本题解析:
本题难度:一般
3、选择题 工业上利用氢气在氯气中燃烧,所得产物再溶于水的方法制得工业用盐酸,流程复杂且造成能量浪费。有人设想利用原电池原理直接制盐酸的同时,获取电能,假设这种想法可行,下列说法肯定错误的是
[? ]
A.两极材料都用石墨,用稀盐酸做电解质溶液
B.通入氢气的电极为原电池的正极
C.电解质溶液中的阳离子向通氯气的电极移动
D.通氯气的电极反应式Cl2+2e-==2Cl-
参考答案:B
本题解析:
本题难度:一般
4、简答题 某课外活动小组用右图进行实验,试回答下列问题.
(1)若开始时开关K与a连接,则B极的电极反应式为______;
(2)若开始时开关K与b连接,则B极的电极反应式为______;总反应的离子方程式为______;
(3)当开关K与b连接时,下列说法正确的是(填序号)______.
①溶液中Na+向B极移动
②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后加入适量的盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24L气体,则溶液中转移了0.2mol电子.
参考答案:(1)若开始时开关K与a连接,该装置构成原电池,铁易失电子而作负极,石墨作正极,负极上铁失电子发生氧化反应,电极反应式为Fe-2e-=Fe2+,
故答案为:Fe-2e-=Fe2+;
(2)若开始时开关K与b连接,该装置构成电解池,石墨作阳极,铁作阴极,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,电极反应式为:2H++2e-=H2↑,电池反应式为:2Cl-+2H2O电解.2OH-+H2↑+Cl2↑,
故答案为:2H++2e-=H2↑;2Cl-+2H2O电解.2OH-+H2↑+Cl2↑;
(3)若开始时开关K与b连接,该装置构成电解池,石墨作阳极,铁作阴极,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,
①阳离子向阴极移动,则钠离子向B极移动,故正确;
②A电极上生成氯气,氯气具有强氧化性,能置换出碘单质,碘与淀粉试液变蓝色,则A极处逸出的气体能使湿润的KI淀粉试纸变蓝,故正确;
③根据“析出什么加入什么”的原则加入物质,阴极上析出氢气,阳极上析出氯气,则应加入氯化氢气体可恢复到电解前电解质的浓度,故错误;
④电子不进入溶液,溶液中通过离子的定向移动而导电,故错误;
故选①②.
本题解析:
本题难度:简单
5、填空题 理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+ =2 Ag +Cu2+ ”设制一个化学电池(正极材料用碳棒),回答下列问题:
该电池的电解质溶液是 ;负极发生 反应(填“氧化”或“还原”),电极反应式
参考答案:(1)硝酸银 ,氧化反应, Cu -2e-=Cu2+
本题解析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,据此可知铜是负极,失去电子,凡是氧化反应,电极反应式是Cu -2e-=Cu2+。银离子在正极得到电子,因此电解质溶液应该是硝酸银溶液。
考点:考查根据原电池的判断和电极反应式的书写
点评:该题是高考中的常见题型,属于基础性试题的考查。试题难易适中,基础性强,侧重考查学生灵活运用原电池原理解决实际问题的能力,有利于提高学生的逻辑推理能力和学习效率。该题的关键是明确原电池的工作原理,然后结合题意灵活运用即可。
本题难度:一般