时间:2020-08-13 07:10:07
1、选择题 阿伏加德罗常数约为6.02×1023mol-1.下列叙述正确的是( )
A.1L0.1mol/L的FeCl3溶液中,Fe3+的数目约为6.02×1022
B.7.8gNa2O2中含有的阴离子数目约为6.02×1022
C.1mol金刚石中含有C-C键的数目约为6.02×1023
D.标准状况下,1L甲醇完全燃烧后生成的CO2分子个数约为(1/22.4)×6.02×1022
2、选择题 设NA为阿伏加德罗常数,下列叙述中正确的是
[? ]
A.常温下11.2 L的甲烷气体含有甲烷分子数为0.5NA个
B.14 g乙烯和丙烯的混合物中总原子数为3NA个
C.0.1 mol/L的氢氧化钠溶液中含钠离子数为0.1NA个
D.5.6 g铁与足量的稀硫酸反应失去电子数为0.3NA个
3、选择题 下列叙述正确的是 ( )
A.同温同压下,相同体积的气体,其分子数一定相等,原子数也一定相等
B.任何条件下,等物质的量的甲烷(CH4)和一氧化碳所含的原子数一定相等
C.同温同压下的二氧化碳气体和氮气,若体积相等,则质量一定相等
D.同温同压下,1L一氧化碳气体一定比1L氧气的质量小
4、选择题 a?mol?Na2SO4中含有b个氧原子,则阿伏加德罗常数可以表示为
[? ]
A.?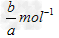
B.?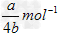
C.? 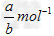 ?
?
D.?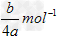
5、选择题 用NA表示阿伏加德罗常数,下列说法中正确的是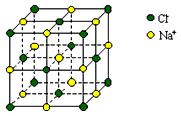
[? ]
A.1L 1 mol·L-1的醋酸溶液中离子总数为2 NA
B.0.05 mol碳酸钠晶体中含离子总数大于0.15NA
C.0.4mol NaCl晶体中含有上图所示的结构单元的数目为0.1 NA
D.标准状况下,22.4L CH3Cl和CHCl3的混合物所含有分子数目为NA