时间:2020-08-13 07:05:37
1、选择题 解释下列物质性质的变化规律与物质结构间的因果关系时,与键能无关的变化规律是( )
A.HF、HCl、HBr、HI的热稳定性依次减弱
B.熔点:Li>Na>K>Rb
C.NaF、NaCl、NaBr、NaI的熔点依次降低
D.H2S的熔沸点小于H2O的熔沸点
参考答案:A.非金属性F>Cl>Br>I,元素的非金属性越强,形成的氢化物共价键的键能越大,对应的氢化物越稳定,故A正确;
B.碱金属元素对应的单质为金属单质,原子半径Li<Na<K<Rb,原子半径越大,金属键越弱,金属晶体的熔点越低,故B正确;
C.NaF、NaCl、NaBr、NaI都为离子晶体,离子半径越小,晶格能越大,故C正确;
D.H2O含有氢键,熔沸点较高,与键能无关,故D错误.
故选D.
本题解析:
本题难度:一般
2、填空题 致冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到致冷目的.人们曾采用过乙醚、NH3、CH3Cl等作致冷剂,但它们不是有毒,就是易燃、于是科学家根据元素性质的递变规律来开发新的致冷剂
据现有知识,某些元素化合物的易燃性、毒性变化趋势如下:
(1)氢化物的易燃性:第二周期______>______>H2O>HF;
(2)化合物的毒性:PH3>NH3;?H2S______H2O;CCl4______CF4?(选填>或<).
(3)已知CCl4的沸点为76.8℃,CF4的沸点为-128℃,新致冷剂的沸点范围应介于其间.经过较长时间反复试验,一种新的致冷剂氟里昂CF2Cl2终于诞生了,其它类似于CF2Cl2的物质还可能有______.(填一种);这类致冷剂的大量使用造成了当今的某一环境问题是______?(选填:温室效应、酸雨、臭氧层空洞、光化学烟雾).
(4)根据周期表中元素及其化合物的______变化趋势来开发致冷剂的科学思维方法是值得借鉴的.(填写字母,多选扣分)①毒性?②沸点?③易燃性?④水溶性?⑤颜色 (a)①②③(b)②④⑤(c)②③④
参考答案:解(1)根据HF的可燃性最小,可知:同周期元素气态氢化物的可燃性从左向右逐渐减弱.故答案为:CH4;NH3;
(2)由“毒性:PH3>NH3,”可知:同主族元素的化合物的毒性从上到下逐渐增大.故答案为:>;>;
(3)由“新的制冷剂沸点”应介于CCl4和CF4之间,将CCl4分子中的Cl原子用F原子取代(或将CF4分子中的F原子用Cl原子取代),可得CCl3F、CCl2F2、CClF3.根据组成和结构相似的物质,沸点随相对分子质量的增大而升高,可知沸点:CF4<CClF3<CCl2F2<CCl3F<CCl4,氯代烃能引起臭氧层空洞,故答案为:CCl3F(或CClF3);臭氧层空洞;
(4)由题意,制冷剂应该是易液化的气体,因此选择②;制冷剂应该无毒,且不易燃烧,因此选择①③,故答案为:a.
本题解析:
本题难度:一般
3、选择题 下列叙述正确的是
A.将一小块铜片放入盛有浓硫酸的试管中加热反应后的溶液呈蓝色
B.将一小块钠放入盛有水的烧杯中钠在水面上游动,同时看到烧杯内的溶液变为红色
C.如图,一段时间后给烧杯内的溶液中加入黄色的K3[Fe(CN)6]溶液,可看到电极附近有蓝色沉淀生成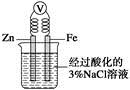
D.向盛有少量Mg(OH)2沉淀悬浊液的试管中滴加氯化铵溶液,可看到沉淀溶解
参考答案:D
本题解析:A项,Cu与浓H2SO4加热反应后溶液不呈蓝色(以固体形式存在),错误;B项,Na和水反应生成NaOH加入酚酞,溶液变红,错误;C项,形成原电池,Zn作负极,所以在Fe电极附近加入K3[Fe(CN)6]不会有蓝色沉淀生成;D项,由于Mg(OH)2(s)=Mg2+(aq)+2OH-(aq),OH-+NH=NH3·H2O,平衡右移,沉淀溶解。
本题难度:一般
4、选择题 下列现象或事实可用同一原理解释的是
A.红墨水和溴水通入二氧化硫褪色
B.实验室可用NaOH 处理NO2和Cl2废气
C.亚硫酸和水玻璃长期暴露在空气中变质
D.浓硫酸和浓盐酸长期暴露在空气中浓度降低
参考答案:B
本题解析:A中红墨水通入二氧化硫褪色是利用二氧化硫的漂白性,溴水中通入二氧化硫褪色是利用二氧化硫的还原性。
B、用NaOH 处理NO2和Cl2废气是利用NaOH的碱性。
C、亚硫酸在空气中变质是被空气中氧气氧化为硫酸,水玻璃在空气中变质是吸收了二氧化碳变成碳酸钠和硅酸。
D、浓硫酸吸收了空气中的水分导致浓度降低,浓盐酸具有挥发性使得其浓度降低。
点评:本题涉及简单化学反应的实验,关键在于平时积累记忆一些常见物质的特殊性。
本题难度:一般
5、选择题 下列叙述中不正确的是( )
A.原子半径:O>S>Cl
B.还原性:Na>Mg>Al
C.稳定性:HF>HCl>HBr
D.酸性:HClO4>H2SO4>H3PO4
参考答案:A、电子层越多半径越大,电子层相同时原子序数越大半径越小,S、Cl同周期,所以半径S>Cl,O元素为上周期元素,所以半径S>Cl>O,故A错误;
B、同周期从左到右金属性减弱,还原性逐渐减弱,所以还原性:Na>Mg>Al,故B正确;
C、同主族从上到下非金属性减弱,氢化物稳定性减弱,所以稳定性:HF>HCl>HBr,故C正确;
D、非金属性越强,最高价含氧酸的酸性越强,同周期从左到右非金属性增强,所以酸性:HClO4>H2SO4>H3PO4,故D正确;
故选A.
本题解析:
本题难度:一般