时间:2020-08-13 07:03:30
1、填空题 (11分)Ⅰ、(1)高锰酸钾是一种典型的强氧化剂。
(1)在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
Ⅰ. MnO4-+ Cu2S + H+→ Cu2+ + SO2↑ + Mn2+ + H2O(未配平)
Ⅱ. MnO4-+ CuS + H+ → Cu2+ + SO2↑ + Mn2+ + H2O(未配平)
请回答下列问题:
①下列关于反应Ⅰ的说法不正确的是??。
A.被氧化的元素是Cu和S
B.MnO4-是氧化剂,Cu2S既是氧化剂又是还原剂
C.氧化剂与还原剂的物质的量之比为8∶5
D.生成2.24 L(标况下) SO2,转移电子的物质的量是0.8 mol
E.氧化性的强弱关系是: MnO4-> Mn2+> Cu2+
②用单线桥表示反应Ⅱ中电子转移的数目和方向:?MnO4-+ CuS
(2)在稀硫酸中,MnO4-和H2O2也能发生氧化还原反应:
氧化反应: H2O2 - 2e-==2H++O2↑
还原反应: MnO4-+5e-+ 8H+===Mn2++4H2O
写出该氧化还原反应的化学方程式:?。
反应中若有0.5 mol H2O2参加此反应,转移电子的个数为?。由上述反应得出的氧化性强弱的结论是?。
②实验中发现,当加入的少量KMnO4完全反应后,H2O2仍能发生反应放出气体。其可能的原因是:?。
参考答案:(11分)(1)① BE?(2分)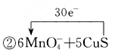 (2分)
(2分)
(2)①5H2O2+2KMnO4+3H2SO4==2MnSO4+5O2↑+K2SO4+8H2O (2分)
6.02×1023(1分)氧化性: KMnO4> H2O2(O2)(2分)
②生成的Mn2+对H2O2分解具有催化作用(2分)
本题解析:(1)①根据反应的方程式可知,铜元素的化合价从+1价升高到+2价,硫元素的化合价从-2价升高到+4价,所以1molCu2S失去8mol电子。而锰元素的化合价从+7价降低到+2价,得到5个电子,所以根据电子得失守恒可知,氧化剂与还原剂的物质的量之比为8∶5。由于在氧化还原反应中,氧化剂的氧化性强于氧化产物的,所以氧化性应该是 MnO4-> Cu2+> Mn2+,因此选项BE是错误的,其余选项都是正确的,答案选BE。
②根据反应的方程式可知,硫元素的化合价从-2价升高到+4价,所以1molCu2S失去6mol电子,所以用单线桥表示反应Ⅱ中电子转移的数目和方向是 。
。
(2)①根据已知的氧化反应和还原反应可知,该反应的方程式是
5H2O2+2KMnO4+3H2SO4==2MnSO4+5O2↑+K2SO4+8H2O;根据氧元素的化合价变化可知,双氧水中氧元素从-1价升高到0价,所以1mol双氧水生成2nol电子,则0.5mol双氧水转移电子的个数是6.02×1023个;由于在氧化还原反应中,氧化剂的氧化性强于氧化产物的,所以氧化性强弱顺序应该是KMnO4> H2O2(O2)。
②加入的少量KMnO4完全反应后,H2O2仍能发生反应放出气体,这说明反应中生成的Mn2+对H2O2分解具有催化作用。
本题难度:一般
2、选择题 将铁粉加入到一定量的硝酸银、硝酸铜及硝酸锌的混合溶液中,待充分反应后过滤,在滤渣中加入稀盐酸,没有气体产生,则在滤液中(? )
A.只有硝酸锌和水
B.一定有硝酸锌和硝酸亚铁
C.一定没有硝酸银
D.一定没有硝酸铜
参考答案:B
本题解析:加入稀盐酸没有气体生成,则固体中没有Fe单质,所以一定有硝酸锌和硝酸亚铁,但却不能判断Ag和Cu是否都已经被完全置换出来了。
本题难度:简单
3、选择题 下列化学反应中,不属于四种基本反应类型的是
[? ]
A.2FeCl3+Cu==2FeCl2+CuCl2
B.
C.4Fe(OH)2+O2+2H2O== 4Fe(OH)3
D.CaCO3+2HCl==CaCl2+H2O+CO2↑
参考答案:A
本题解析:
本题难度:简单
4、选择题 ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:
2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O下列说法正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O下列说法正确的是
[? ]
A.KClO3在反应中得到电子
B.ClO2是氧化产物
C.H2C2O4在反应中被氧化
D.1 molKClO3参加反应有2mol电子转移
参考答案:AC
本题解析:
试题分析:
选项A,KClO3在反应中得到电子,Cl元素化合价降低;
选项B,ClO2是还原产物;
选项C,H2C2O4在反应中被氧化,C元素化合价升高;
选项D,1 molKClO3参加反应有1mol电子转移。
故选:AC
本题难度:简单
5、选择题 随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了防止中秋月饼等富脂食品氧化变质,延长食品的保质期,在包装袋中常加入抗氧化物质,下列不属于抗氧化物质的是(?)
A.维生素C
B.还原铁粉
C.亚硫酸钠
D.生石灰
参考答案:D
本题解析:物质的氧化性、还原性的问题在实际生活中有广泛的体现,如食品的防腐、钢铁的生锈、工业制酸等都涉及氧化还原反应。本题主要是针对食品易氧化变质,要求我们选择合适的还原剂抑制其氧化变质的速率。题给选项中A、B、C都是常见的还原剂,能够吸收空气中的O2而减缓食品与O2的接触,从而能起到延长食品保质期的目的。D项的CaO只能吸收水分、干燥食品,不能吸收O2,故不能起到应有的作用,故应选D项。
点评:本题考查氧化还原反应的知识,判断还原剂及其应用机理,题目难度不大。
本题难度:简单