时间:2020-08-13 07:02:49
1、选择题 下列物质的用途说法不正确的是
[? ]
A.利用铝热反应焊接铁轨?
B.苏打是治疗胃酸过多的一种药剂
C.明矾可用于净水?
D.镁合金密度小,硬度和强度大,可用于制造飞机的部件?
参考答案:B
本题解析:
本题难度:简单
2、填空题 氧化镁是一种优良的高温耐火材料。如图是一种制取高纯氧化镁的部分工艺流程。 请回答下列问题。 
(1) MgCl2.6H2O溶于水,溶液呈____(填“酸性”、“中性”或“碱性”)。
(2)氨化反应过程中反应的离子方程式为__。
(3)轻烧后的产物为___。
(4)写出用石灰乳蒸氨的化学方程式___。
(5)25℃时,Ksp[Mg(OH)2] =5.6×10-12,酸碱指示剂百里酚蓝的变色范围如下。 25℃时,在Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为___。
参考答案:(1)酸性
(2) Mg2++2NH3.H2O=Mg(OH)2↓+2NH4+
(3)MgO(或氧化镁)
(4)Ca(OH)2 +2NH4Cl 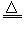 CaCl2 +2NH3↑+2H2O
CaCl2 +2NH3↑+2H2O
(5)蓝色
本题解析:
本题难度:一般
3、填空题 工业上用重晶石(主要成分BaSO4)为原料制备BaCl2和锌钡白,生产过程中会产生大量废气(主要成分为CO2、CO及少量SO2和硫蒸气等),为防止污染空气并提高原料利用率,生产中采用下述工艺流程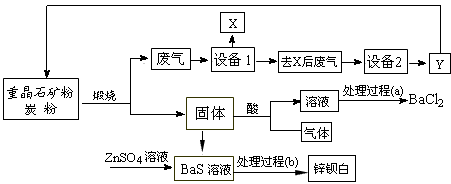
请根据上述流程回答下列问题
(1)假设煅烧时还原产物只有BaS,则反应的化学方程式为___________________________;
(2)设备2中所用的洗涤剂是碱液,则Y的化学式为________________________;
(3)溶解固体所用的酸为____________(写化学式),生成的气体用过量NaOH溶液吸收,其反应的离子方程式为_______________________________;
(4)处理过程(b)的具体步骤为______________________;
(5)锌钡白的成分是___________________(写化学式)。
参考答案:(1)BaSO4+4C 4CO↑+BaS(或BaSO4+2C
4CO↑+BaS(或BaSO4+2C 2CO2↑+BaS)
2CO2↑+BaS)
(2)CO
(3)HCl;2OH-+H2S==S2-+H2O
(4)过滤、洗涤、干燥
(5)BaSO4和ZnS
本题解析:
本题难度:一般
4、填空题 某地有软锰矿和闪锌矿两座矿山,它们的组成如下:软锰矿:MnO2含量≥65 %,SiO2含量约为20%,
Al2O3含量约为4%,其余为水分;闪锌矿:ZnS含量≥ 80%,FeS、CuS、SiO2含量约为7%,其余为水分。科研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如下图所示。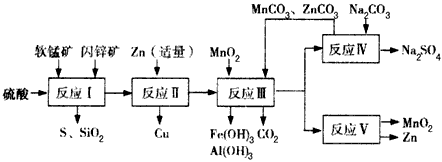
请回答下列问题:
(1)反应I后过滤所得滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等。试写出反应I中生成
CuSO4的化学方程式_____________________。
(2)反应Ⅱ加入适量锌的作用是________________________。如果锌过量,还会进一步发生反应的离子方程式为________________________。
(3)反应V的条件是电解,电解时均用惰性电极,阳极发生的电极反应可表示为____________。
(4)本工艺所用的原料除软锰矿、闪锌矿、硫酸外还需要________等原料。
参考答案:(1)MnO2+CuS+2H2SO4=S+MnSO4+CuSO4+2H2O
(2)将溶液中的硫酸铜转化为铜;Zn+Fe2+ =Fe+Zn2+
(3)Mn2+-2e-+2H2O=MnO2+4H+
(4) Na2CO3、Zn、MnO2
本题解析:
本题难度:一般
5、填空题 CoCl2·6H2O是一种饲料营养强化剂,以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图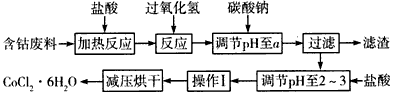
已知:
①钴与盐酸反应的化学方程式为Co+2HCl=CoCl2+H2↑。
②CoCl2·6H2O的熔点为86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表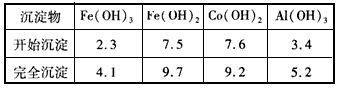
请回答下列问题:
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点是
___________________
(2)加入碳酸钠调节pH至a,a的范围是_______________。
(3)操作I包含3个基本实验操作,它们是____________和过滤。
(4)制得的CoCl2·6H2O需减压烘干的原因是______________________。
(5)为测定产晶中CoCl2·6H2O的含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是__________________。
(6)在实验室中,为了从上述产品中获得纯净的CoCl2·6H2O,采用的方法是_____________。
参考答案:(1)减少有毒气体的排放,防止大气污染,防止产品中混有硝酸盐
(2)5.2~7.6
(3)蒸发浓缩、冷却结晶
(4)降低烘干温度,防止产品分解
(5)样品中含有NaCl杂质,烘干时失去了部分结晶水
(6)将产品溶于乙醚,过滤后,再蒸馏
本题解析:
本题难度:一般