时间:2020-08-13 07:02:49
1、选择题 下列说法中,错误的是( )
A.天然气的主要成分是CH4
B.淀粉、纤维素、蚕丝、油脂都是高分子化合物
C.煤是由有机物和无机物组成的复杂的混合物
D.石油的分馏产品如汽油、煤油、柴油等都是混合物
参考答案:B
本题解析:
本题难度:简单
2、填空题 硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制 备高纯硅的主要方法,生产过程示意图如下: 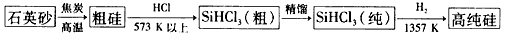
①写出由纯SiHCl3,制备高纯硅的化学反应方程式________________________。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式______________________________;H2还原SiHCl3 过程中若混入O2,可能引起的后果是_________________________________。
(2)下列有关硅材料的说法正确的是____(填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料--光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅?
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡。写出实验现象并给予解释________。
参考答案:(1)①SiHCl3+H2 Si+3HCl;②SiHCl3+3H2O= H2SiO3↓十3HCl↑+H2↑ 氧气与氢气混合,可能引起爆炸,氧气可能会氧化SiHCl3,
Si+3HCl;②SiHCl3+3H2O= H2SiO3↓十3HCl↑+H2↑ 氧气与氢气混合,可能引起爆炸,氧气可能会氧化SiHCl3,
(2)BC
(3)现象:试管中有白色胶状沉淀生成,并且有刺激性气体生成。
本题解析:
本题难度:一般
3、选择题 属于铝热反应的是
[? ]
A、Al+HCl?
B、Al+?Fe2O3?
C、Al+NaOH?
D、Al+O2
参考答案:B
本题解析:
本题难度:简单
4、填空题 利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的工艺如下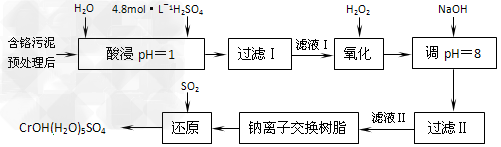
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4?mol·L-1的浓硫酸配制250?mL?4.8?mol·L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需______________。
(2)酸浸时,为了提高浸取率可采取的措施有_________、___________。
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:___________________________。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下 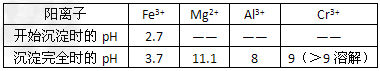
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-。滤液Ⅱ中阳离子主要有_________;但溶液的pH不能超过8,其理由是________________。
(5)钠离子交换树脂的反应原理为:Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是________________。
(6)写出上述流程中用SO2进行还原的化学方程式____________________。
参考答案:(1)250mL容量瓶、胶头滴管
(2)升高反应温度、增大固体颗粒的表面积、加快搅拌速度等
(3)2Cr3+?+?3H2O2?+?H2O?=?Cr2O72-+?8H+
(4)Na+、Mg2+、Ca2+;pH超过8会使部分Al(OH)3溶解生成AlO2-,最终影响Cr(III)回收与再利用
(5)Ca2+、Mg2+
(6)3SO2?+?2Na2CrO4?+?12H2O?=?2CrOH(H2O)5SO4↓+?Na2SO4?+?2NaOH?(或3SO2?+?2CrO42-?+?12H2O?=?2CrOH(H2O)5SO4↓+?SO42-?+?2OH-)
本题解析:
本题难度:一般
5、填空题 2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的,回收利用锂资源成为重要课题。某研究小组对某废旧锂离子电池正极材料(图中简称废料,成份为LiMn2O4、石墨粉和铝箔)进行回收研究,工艺流程如下:
已知:Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g。 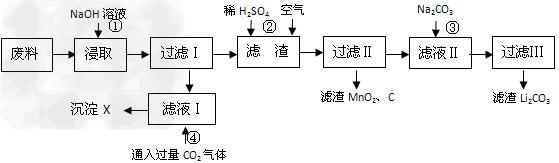
(1)废料在用NaOH溶液浸取之前需要进行粉碎操作,其目的是_______________。
(2)废旧电池可能由于放电不完全而残留有锂单质,为了安全对拆解环境的要求__________________________。
(3)写出反应④生成沉淀X的离子方程式:________________________?。
(4)己知LiMn2O4中Mn的化合价为+3和+4价,写出反应②的化学反应方程式:_____________________________。
(5)生成Li2CO3的化学反应方程式为___________________。已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应______________。
参考答案:(1)增大接触面积,加快反应速率
(2)隔绝空气和水分
(3)CO2+AlO2–+2H2O=Al(OH)3↓+HCO3–
(4)4LiMn2O4+2H2SO4+O2=8MnO2+2?Li2SO4+2H2O
(5)Li2SO4+Na2CO3=Na2SO4+Li2CO3↓;趁热过滤
本题解析:
本题难度:一般