时间:2020-08-13 07:02:29
1、填空题 工业上用含锌物料(含FeO、CuO等杂质)可制得活性ZnO,流程如下: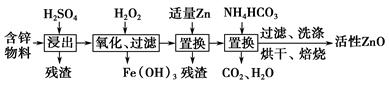
(1)上述流程中,浸出用的是60%H2SO4(1.5 g·cm-3),配制这种H2SO4 100 mL需要18.4 mol·L-1的浓H2SO4________ mL(保留一位小数)。
(2)加入氧化剂H2O2后,有Fe(OH)3沉淀出现,没有Cu(OH)2沉淀出现,若溶液中c(Fe3+)=2.6×10-18 mol·L-1,则溶液中c(Cu2+)的取值范围是________mol·L-1。(已知Ksp[Fe(OH)3]=2.6×10-39,
Ksp[Cu(OH)2]=2.2×10-20)
(3)加入NH4HCO3后生成的沉淀是形态均为Zna(OH)b(CO3)c(a、b、c为正整数)的两种碱式碳酸锌A和B的混合物,A中a=5、b=6,则生成碱式碳酸锌A的化学方程式为__________________________________________________。
(4)取洗涤、烘干后的碱式碳酸锌A和B的混合物49.70 g,其物质的量为0.10 mol,高温焙烧完全分解得到37.26 g ZnO、3.584 L CO2(标准状况下)和水,通过计算求出碱式碳酸锌B的化学式。
2、选择题 某物质A在一定条件下加热分解,产物都是气体。分解的化学方程式为2A = B+2C+2D,测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为
[? ]
A.2d
B.2.5d
C.5d
D.10d
3、计算题 (8分)实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定甲、乙两瓶溶液的成分及物质的量浓度,进行以下实验:
①取25mL甲溶液,向其中缓慢滴入乙溶液15mL,共收集到112mL(标准状况)气体。
②取15mL乙溶液,向其中缓慢滴入甲溶液25mL,共收集到56mL(标准状况)气体。
(1)判断:甲是 溶液,乙是 溶液;(均填化学式)
(2)甲溶液的物质的量浓度为 mol/L,乙溶液的物质的量浓度
为 mol/L, (要求写出计算过程)。
4、简答题 把2.0mol/L Fe2(SO4)3和1.0mol/L H2SO4溶液等体积混合(假设混合后溶液的体积等于混合前两种溶液的体积之和.计算:
(1)混合液中Fe2(SO4)3、SO42-的物质的量浓度各是多少?
(2)向溶液中加入足量铁粉,经足够长的时间后,铁粉有剩余.此时溶液中Fe2+的物质的量浓度是多少?
5、选择题 若NA表示阿伏加德罗常数的值,下列说法正确的是
A.铁制品上电镀锌时,阴极质量每增加65g时转移的电子数是2NA
B.5.6L Cl2与足量铁粉反应时转移的电子数为0.5NA
C.1L 1mol·L-1的CH3COOH溶液中含有H+的数目是NA
D.1L 0.5mol·L-1的Na2CO3溶液中含有CO32-的数目是0.5NA