时间:2020-08-13 06:58:20
1、简答题 实验室需要0.1mol/L盐酸溶液450mL,配制过程如下:
A、在盛盐酸的烧杯中注入适量蒸馏水,并用玻璃棒搅拌,使其混合均匀.
B、在盐酸稀释后,沿①______注入②______中.
C、用③______量取1.19g/cm3,37%的浓盐酸④______毫升注入烧杯中.
D、用适当蒸馏水洗涤烧杯及玻璃棒2~3次,将溶液一并注入②中.
E、往②中小心加蒸馏水至液面接近刻度线2~3cm处,改用⑤______加蒸馏水,使溶液的⑥______与瓶颈刻度相切.
F、采用标准的操作方法摇匀,并转移入试剂瓶中贴上标签.
(1)在横线上填上适当的仪器名称,操作方法;
(2)正确的实验步骤是______.
(3)在配制上述溶液实验中,下列操作引起结果(浓度)偏低的有______(填序号)
A、在烧杯中稀释溶质搅拌时,溅出少量溶液
B、没有用蒸馏水洗烧杯2-3次,并将洗液移入②中
C、定容时,加水超过了刻度线,倒出一些再重新加水到刻度线
D、将所配溶液从②转移到试剂瓶时,有少量溅出
E、把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用
F、②刚用蒸馏水洗净,没有烘干.
参考答案:(1)B、要将稀释液通过玻璃棒转移到500mL容量瓶中,
故答案为:玻璃棒;500mL容量瓶;
C、浓盐酸的物质的量浓度=1000×1.19×37%36.5mol/L=12.06mol/L,根据稀释前后氯化氢的物质的浓盐酸的体积=0.1mol/L×0.5L12.06mol/L=4.1mL,用10mL量筒量取4.1mL浓盐酸,
E、⑤定容时用胶头滴管定容,当溶液的凹液面底部与瓶颈刻度相切即可,
故答案为:玻璃棒,500mL容量瓶,10mL量筒,4.1,胶头滴管,凹液面底部;
(2)实验操作的步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等,所以其排列顺序是
CABDEF,故答案为:CABDEF;
(3)A、在烧杯中稀释溶质搅拌时,溅出少量溶液,导致溶质的物质的量偏小,配制溶液浓度偏低;
B、没有用蒸馏水洗烧杯2-3次,并将洗液移入②中,致溶质的物质的量偏小,配制溶液浓度偏低;
C、定容时,加水超过了刻度线,倒出一些再重新加水到刻度线,致溶质的物质的量偏小,配制溶液浓度偏低;
D、将所配溶液从②转移到试剂瓶时,有少量溅出,溶液已经配制完,试剂瓶内液体浓度不变;
E、把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用,溶液体积偏大,导致浓度偏低;
F、②刚用蒸馏水洗净,没有烘干,溶质的物质的量及溶液的体积都不变,配制溶液浓度无影响;
故选ABCE.
本题解析:
本题难度:一般
2、简答题 用18.4mol/L的浓硫酸配制1mol/L稀硫酸l00mL,其操作有以下各步:
完成下列填空:
(1)供选用的仪器有:①玻璃棒;②胶头滴管;③10mL量筒;④100mL容量瓶;⑤5mL量筒;⑥100mL量筒;⑦50mL烧杯;⑧药匙;应选用的仪器(填编号)______.
(2)用量筒量取浓硫酸时;如果读量筒刻度时仰视,配制的硫酸浓度将偏______(填大或小).
(3)简述浓硫酸稀释的操作______;
(4)浓硫酸稀释后,必须______后才能将液体转移到容量瓶中.
参考答案:(1)配制顺序是:计算→量取→稀释、冷却→移液→定容→摇匀→装瓶→贴签,一般用量筒量取(用到胶头滴管)称量,在烧杯中稀释,冷却后转移到100mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀,所以仪器有烧杯、玻璃棒、量筒、100mL容量瓶、胶头滴管,
故答案为:①②③④⑦;
(2)如果对装有浓硫酸的量筒仰视读数,则量取的浓硫酸的体积偏大,溶质的物质的量偏多,所配制的溶液的浓度偏大,故答案为:大;
(3)稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散,切不可把水注入浓硫酸中;
故答案为:将浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;
(4)因浓硫酸稀释放热,热溶液的体积大,一旦冷却下来体积偏小,影响溶液的浓度,所以必须冷却至室温才能转移至容量瓶;
故答案为:冷却.
本题解析:
本题难度:一般
3、选择题 配置250mL0.100mol/L的氯化钠溶液,操作不正确的是( )
A.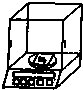
称量
B.
溶解
C.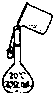
转移
D.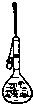
定容
参考答案:A、称量氯化钠采用分析天平更精确,图中实验操作正确;
B、溶解氯化钠时,为了加速其溶解,可以用玻璃棒搅拌,图中实验操作正确;
C、转移时用玻璃棒引流,防流出容量瓶外,图中操作无玻璃棒,图中实验操作错误;
D、定容时用胶头滴管操作,图中实验操作正确;
故选C.
本题解析:
本题难度:一般
4、简答题 如图1是硫酸的试剂标签上的部分内容.某次学生实验需要0.5mol?L-1H2SO4溶液480mL,若由你来配制所需溶液,请根据实验室已有的仪器和药品情况回答下列问题:
(1)容量瓶应如何检漏:______.
(2)实验中除量筒、烧杯外还需要的其他仪器______.
(3)计算所需浓硫酸的体积约为______mL;若将该硫酸与等体积的水混合,所得溶液中溶质的质量分数______49%(填“<”、“=”或“>”).
(4)配制过程中需先在烧杯中将浓硫酸进行稀释.稀释的操作方法是______.
(5)下列操作会引起所配溶液浓度偏大的是______(填字母).A.用量筒量取浓硫酸时,仰视量筒的刻度B.向容量瓶中转移时,有少量液体溅出C.定容时仰视刻度线D.定容后倒置摇匀后再正立时,发现液面低于刻度线
(6)温度计、量筒、滴定管的一部分如图2所示,下述读数(虚线所指刻度)及说法正确的是______(填字母).A.①是量筒,读数为2.5mLB.②是量筒,读数为2.5mLC.③是滴定管,读数为2.5mLD.①是温度计,读数为2.5℃
参考答案:(1)容量瓶检漏的方法是加适量水后塞紧瓶塞倒置不漏水,然后正放,应注意瓶塞要旋转180度,再倒置看是否漏水,
故答案为:将瓶塞打开,加入少量水,塞好瓶塞,倒转不漏水,然后正放,把瓶塞旋转180度,再倒转不漏水,则说明该容量瓶不漏水;
(2)由于没有480mL的容量瓶,故应使用500mL的容量瓶,根据配制过程可知,还缺少500mL容量瓶、玻璃棒、胶头滴管,
故答案为:500mL容量瓶、玻璃棒、胶头滴管;
(3)由所给浓硫酸标签上的数据易求得该硫酸浓度为:18.4mol?L-1,故配制500mL0.5mol?L-1的稀溶液时约需要13.6mL浓硫酸,
故答案为:13.6;>;
(4)稀释浓硫酸时应将浓硫酸沿器壁慢慢加入到水中,并不断搅拌,操作方法为:向烧杯中先加入适量蒸馏水,再将量取的浓硫酸沿烧杯内壁慢慢倒入烧杯中,并用玻璃棒不断搅拌,
故答案为:向烧杯中先加入适量蒸馏水,再将量取的浓硫酸沿烧杯内壁慢慢倒入烧杯中,并用玻璃棒不断搅拌;
(5)仰视量筒时,量筒中实际液面高于看到的液面,导致硫酸取多了,结果偏高;B、C两个选项操作均引起结果偏低,
故答案为:A;
(6)A.量筒上没有0刻度值,故A错误;
B.量筒的读数能够读到0.1mL,图②中液体体积为2.5mL,故B正确;
C.滴定管读数时应保留两位小数,正确读数为2.50mL,故C错误;
D.只有温度计的0刻度下还有数据,且图示温度为2.5℃,故D正确;
故答案为:BD.
本题解析:
本题难度:一般
5、选择题 向等体积等物质的量浓度的NaCl、MgCl2两溶液中分别滴加等浓度的AgNO3溶液使Cl-恰好沉淀完全,则消耗AgNO3溶液的体积之比为
A.1:1
B.1:2
C.2:1
D.1:3
参考答案:B
本题解析:分析:等体积、等物质的量浓度的NaCl、MgCl2两种溶液中溶质的物质的量相等,分别与等物质的量浓度的AgNO3溶液恰好完全反应,则消耗的硝酸银的物质的量之比等于它们的体积比.
解答:设等体积、等物质的量浓度的NaCl、MgCl2溶液中溶质的物质的量均为1mol,
则与等物质的量浓度的AgNO3溶液恰好完全反应时存在:
1molNaCl~1molAgNO3,
1molMgCl2~2molAgNO3,
由n=cV可知,物质的量之比等于溶液的体积之比,
所以与NaCl、MgCl2两种溶液反应的AgNO3溶液的体积比为1:2,
故选B.
点评:本题考查物质的量浓度的计算,明确物质的量、浓度及物质的构成的关系,氯离子与银离子的反应是解答本题的关键,难度不大.
本题难度:简单