时间:2020-08-13 06:57:38
1、选择题 下列叙述正确的是( )
A.1 mol H2O的质量为18g/mol
B.CH4的摩尔质量为16g
C.3.01×1023个SO2分子的质量为32g
D.标准状况下,1 mol任何物质体积均为22.4L
参考答案:C
本题解析:A 错误,1 mol H2O的质量为18g
B 错误,CH4的摩尔质量为16g/mol
C 正确,3.01×1023个SO2为0.5mol,质量为32g
D 错误,标准状况下,1 mol任何气体的体积均为22.4L
本题难度:一般
2、选择题 说法正确的是
A.0.5molO3与11.2L NO2所含的分子数一定相等
B.中和等体积、等物质的量的浓度的盐酸和醋酸所消耗的n(NaOH)不相等
C.常温Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D.常温常压,7.0g乙烯与丙烯的混合物含有氢原子的数目为NA
参考答案:D
本题解析:选项A不正确,因为11.2LNO2不一定是0.5mol;等体积、等物质的量的浓度的盐酸和醋酸的物质的量是相等的,消耗氢氧化钠相等,选项B不正确;在加热的条件下,钠和氧气反应生成过氧化钠,选项C不正确;乙烯和丙烯的最简式相等,都是CH2,所以选项D正确,答案选D。
本题难度:简单
3、选择题 在t℃时将a g NH3完全溶于水,得到V mL溶液,假如该溶液的密度为d g/cm3,质量分数为ω,其中含NH4+的物质的量为b mol。下列叙述正确的是( )
A.溶质的质量分数为ω=×100%
B.氨水的物质的量浓度为1000a/(35V)mol·L-1
C.溶液中c(OH-)=1000b/V mol·L-1+c(H+)
D.上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5ω
参考答案:C
本题解析:A、氨水溶液溶质为氨气,该溶液的密度为ρ g?cm-3,体积为VmL,所以溶液质量为ρVg,溶质氨气的质量为ag,溶质的质量分数为ag /(ρVg) ×100%,故A错误;
B、水的密度比氨水的密度大,相等体积的氨水与水,水的质量大,等体积混合后溶液的质量大于原氨水的2倍,溶液中氨气的质量相同,等体积混合所得溶液溶质的质量分数小于0.5w,
故B错误;
C、溶液OH-中来源与一水合氨、水的电离,NH4+的浓度为bmol /(V×10-3L) ="1000b" /V? (mol/L),一水合氨电离NH3?H2O?NH4++OH-,一水合氨电离出的OH-为1000b /V? (mol/L),所以溶液中OH-浓度大于1000b /V? (mol/L),故C错误;
D、a g NH3的物质的量为ag /(17g/mol) ="a" /17 (mol),溶液体积为VmL,所以溶液的物质的量浓度为 =
= ?mol/L,故D正确.
?mol/L,故D正确.
故选:D.
点评:考查物质的量浓度、质量分数的计算与相互关系等,难度中等,理解概念是解题的关键.
本题难度:一般
4、填空题 将CO2通入NaOH溶液中,所得产物随通入的CO2的物质的量的不同而不同。完成下列填空。
(1)250 mL 1 mol/L的NaOH溶液,最多可吸收CO2?L(标准状况下)。
(2)向250 mL 2 mol/L的NaOH溶液中通入一定量CO2,溶液增重4.4 g,将所得溶液蒸干,计算所得固体中各成分的物质的量。
向未知浓度、体积为V L的 NaOH溶液中缓缓通入一定体积(标准状况下)的CO2,充分反应后,在减压低温的条件下蒸发溶液,得到白色固体。
(3)若反应中CO2和NaOH均无剩余,反应后向溶液中加入过量的澄清石灰水生成m1 g 白色沉淀。
①根据以上数据,用代数式表示CO2的体积V(CO2)=?。
②根据以上数据,推理计算出NaOH溶液的浓度范围。
(4)写出确定NaOH浓度的实验步骤,并用代数式表示NaOH溶液的浓度。(设计实验方案时,只能用题中提供的CO2和NaOH溶液,不得使用其它化学试剂。)
实验步骤:?。c(NaOH)=?。
参考答案:(1)5.6 L (1分)
(2)Na2CO3? 0.1 mol ;? NaOH? 0.3 mol(4分)
(3)①V(CO2)=0.224m1 L? 2分)?②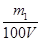 ≤ c(NaOH) ≤
≤ c(NaOH) ≤ 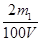 (每种情况各1分,共3分)
(每种情况各1分,共3分)
(4)取V L NaOH溶液,称量,缓缓向其中通入CO2直至恒重,称量。测得其增重为m3 g。(2分)
c(NaOH)=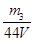 ?mol/L(2分)
?mol/L(2分)
或者:取V L NaOH溶液,缓缓向其中通入过量的CO2,充分反应后减压低温蒸发溶液,得固体NaHCO3,称其质量为m3 g。(2分)
c(NaOH)= mol/L(2分)?(其它合理答案也给分)
mol/L(2分)?(其它合理答案也给分)
本题解析:(1)250 mL 1 mol/L的NaOH溶液中氢氧化钠的物质的量为0.25mol,则根据方程式NaOH+CO2=NaHCO3可知,最多可吸收CO2的物质的量为0.25mol,在标准状况下的体积为0.25mol×22.4L/mol=5.6L。
(2)向250 mL 2 mol/L的NaOH溶液中通入一定量CO2,溶液增重4.4 g,这说明参加反应的CO2的质量是4.4g,物质的量为0.1mol。氢氧化钠的物质的量为0.5mol,因此根据反应式2NaOH+CO2=Na2CO3+H2O可知氢氧化钠是过量的,所以所得固体为氢氧化钠和碳酸钠的混合物,其中碳酸钠0.1mol,氢氧化钠是0.5mol-0.1mol×2=0.3mol。
(3)①生成物不论是碳酸钠还是碳酸氢钠均能与氢氧化钙反应生成碳酸钙白色沉淀,则根据碳元素守恒可知CO2的物质的量是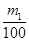 mol,在标准状况下的体积为
mol,在标准状况下的体积为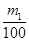 mol×22.4L/mol=0.224m1 L。
mol×22.4L/mol=0.224m1 L。
②如果生成物只有NaHCO3时,则根据原子守恒可知c(NaOH)= 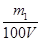 ;当生成物只有Na2CO3时,同样依据原子守恒可知c(NaOH)=
;当生成物只有Na2CO3时,同样依据原子守恒可知c(NaOH)= 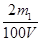 ;当生成物是Na2CO3和NaHCO3时,消耗NaOH在上述两者之间。所以:
;当生成物是Na2CO3和NaHCO3时,消耗NaOH在上述两者之间。所以: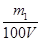 ≤ c(NaOH) ≤
≤ c(NaOH) ≤ 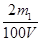 。
。
(4)要测定氢氧化钠溶液的浓度,则可以将其转化为碳酸氢钠,然后通过称量其质量得出氢氧化钠的质量,进而得出其浓度,或者计算参加反应的二氧化碳质量,进而得出氢氧化钠的物质的量,所以正确的实验步骤可以为:取V L NaOH溶液,称量,缓缓向其中通入CO2直至恒重,称量。测得其增重为m3 g。由于增加的质量即为参加反应的CO2质量,所以根据原子守恒可知碳酸氢钠的物质的量为 ,则氢氧化钠的物质的量也是
,则氢氧化钠的物质的量也是 ,所以其浓度为
,所以其浓度为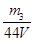 。或者取V L NaOH溶液,缓缓向其中通入过量的CO2,充分反应后减压低温蒸发溶液,得固体NaHCO3,称其质量为m3 g。则碳酸氢钠的物质的量为
。或者取V L NaOH溶液,缓缓向其中通入过量的CO2,充分反应后减压低温蒸发溶液,得固体NaHCO3,称其质量为m3 g。则碳酸氢钠的物质的量为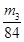 ,则根据原子守恒可知氢氧化钠的物质的量也是
,则根据原子守恒可知氢氧化钠的物质的量也是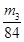 ,所以其浓度为
,所以其浓度为 。
。
本题难度:一般
5、实验题 (8分)用氯化钠固体配制1.00mol/L的NaCl溶液500mL,回答下列问题
(1)请写出该实验的实验步骤
①计算,②称量,③ ,④冷却,⑤移液,⑥洗涤并移液,⑦ ,⑧ 摇匀。
(2)所需仪器为:500mL容量瓶、托盘天平、玻璃棒、烧杯,还必需一个仪器,该仪器的名称是: 。使用容量瓶前必须进行的操作是 。用托盘天平称取氯化钠固体的质量是________g
(3)试分析下列操作对所配溶液的浓度有何影响。(填“偏高”或“偏低”或“无影响”)
①容量瓶没有干燥,有少量的蒸馏水:
②定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度: 。
③定容是俯视刻度线: 。
参考答案:(1)溶解;定容(2)胶头滴管;检查是否漏水;29.3(3)①无影响②偏低③偏高
本题解析:考查一定物质的量浓度溶液的配制及有关误差分析。
(1)根据实验的原理可知,基本的实验步骤是①计算,②称量,③溶解,④冷却,⑤移液,⑥洗涤并移液,⑦定容,⑧ 摇匀。
(2)定容时需要胶头滴管,所以还缺少的仪器是胶头滴管;容量瓶在使用之前必须检验是否漏水;500mL1.00mol/L的NaCl溶液中含有溶质是0.5L×1.00mol/L=0.5mol,所以其质量是0.5mol×58.5g/mol=29.3g。
(3)根据c=n/V可知,若容量瓶没有干燥,有少量的蒸馏水,但n和V不变,所以浓度不变;液面低于刻度线,又滴加蒸馏水至刻度,则V偏大,浓度偏低;定容是俯视刻度线,则容量瓶中溶液的体积偏小,浓度偏高。
本题难度:一般