时间:2020-08-13 06:56:55
1、选择题 已知主族元素A和B的原子序数分别为a和b,且原子半径为B>A,则下列说法中正确的是( )
A.a一定大于b
B.若A和B不在同一周期,则a一定大于b
C.a一定小于b
D.若A和B在同一周期,a一定大于b
2、选择题 J、L、M、R是原子序数依次增大的短周期主族元素,J、M在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;L是地壳中含量排第二位的元素.下列说法正确的是( )
A.J在周期表的位置是第二周期ⅣA族
B.M元素的氢化物在同主族元素氢化物中最稳定
C.R元素的最高价氧化物对应的水化物的酸性最强
D.L的氧化物易溶于水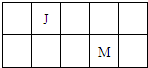
3、选择题 分子有极性分子和非极性分子之分。下列对极性分子和非极性分子的认识不正确的是
[? ]
A.只含非极性键的分子一定是非极性分子
B.含有极性键的分子一定是极性分子
C.非极性分子可能含有非极性键,也可能含有极性键,或同时含有极性键和非极性键
D.极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂
4、填空题 (15分)已知:A、B、C、D、E、F六种元素核电荷数依次增大,属周期表中前四周期的元素。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中最高;F能形成红色(或砖红色)的F2O和黑色的FO两种氧化物。
回答下列问题:
(1)F的原子的M层电子排布式为?。
(2)B、C、D的第一电离能由小到大的顺序为?。(用元素符号表示)
(3)A的简单氢化物分子极易溶于水,其主要原因是?.
(4)E的最高价氧化物分子的空间构型是?。其中心原子的杂化方式为?。
(5)F的高价离子与A的简单氢化物形成的配离子,配位数为?。
(6)A、F形成某种化合物的晶胞结构如图所示,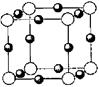 则其化学式为?;(黑色球表示F原子),已知紧邻的白球与黑球之间的距离为a cm, 该晶胞的密度为??g/cm3。
则其化学式为?;(黑色球表示F原子),已知紧邻的白球与黑球之间的距离为a cm, 该晶胞的密度为??g/cm3。
5、选择题 2007年9月,美国科学家宣称:普通盐水在无线电波的照射下可燃烧,这项伟大的发现,有望解决用水作人类能源的重大问题。无线电频率可以降低盐水中所含元素之间的“结合力”,释放出氢原子,若点火,氢原子就会在该种频率下持续燃烧。上述中“结合力”实质是
[? ]
A.分子间作用力
B.氢键
C.非极性共价键
D.极性共价键