时间:2020-08-13 06:52:06
1、选择题 从平时学生实验中我们发现,同学们在进行实验时,出现许多不正确的操作方式,希望同学们在今后的实验中,应该克服不规范的操作。请找出下列图示中正确的实验操作(?)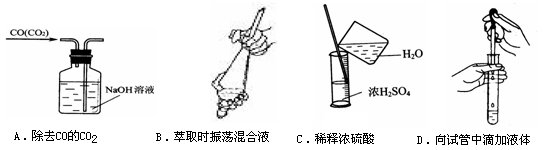
参考答案:B
本题解析:A选项错误,气体进口应插入液面下,出口应在液面以上。B选项正确。C选项错误,应向水中加入浓硫酸。D选项错误,滴灌应在试管口外,不应伸入试管。
本题难度:一般
2、选择题 下列事故处理措施正确的是
A、有人不慎跌入含有大量二氧化碳的深洞中,立即下洞救人
B、苯酚沾到皮肤上,应立即用酒精洗涤
C、稀NaOH溶液沾到皮肤上速用水洗,再涂上硼酸溶液
D、万一眼睛里溅进盐酸,速加NaOH溶液到眼睛中中和
参考答案:BC
本题解析:A不正确,应该迅速通氧。酸和碱发生中和反应,放热会进一步烧伤眼睛,D不正确,其余是正确的,答案选BC。
本题难度:简单
3、实验题 亚硝酸钠(NaNO2)是一种外观与食盐相似的食品添加剂。某化学兴趣小组进行如下实验。
【实验I】
用如下装置(已省略夹持装置)制NaNO2。
已知:2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3。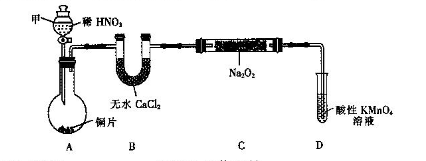
(1)仪器甲的名称是________.装置B的作用是_________________________。
(2)装置D可将剩余的NO氧化成NO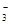 ,发生反应的离子方程式为_____________。
,发生反应的离子方程式为_____________。
(3)使用气密性良好的上述装置进行实验,NaNO2的纯度较低。为提高NaNO2纯度须对
上述实验装置或药品进行改进,其改进措施是________________________________。
【实验Ⅱ】
利用目视比色法(比较溶液颜色深浅以测定物质浓度)测定泡菜样品中NaNO2的含量。
步骤i:在5个有编号的试管中分别加入不同量的NaNO2溶液,各加入1 mL的M溶液 (M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为l0 mL并振荡,制成标准色阶。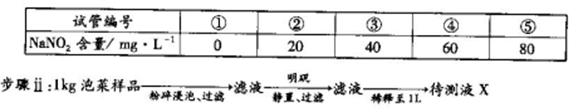
步骤ⅲ:取5 mL待测液X,加入1 mLM溶液,加蒸馏水至10mL振荡,与标准色阶比较。
(4)步骤ii获取待测液X的过程中,加入明矾的目的是__________。
(5)步骤iii比较结果与④号色阶颜色相同,此泡菜样品中NaNO2的含量为_________mg·kg-1
(6)用目视比色法证明泡菜中加入维生素C可以降低NaNO2的含量。设计并完成下列实
验报告。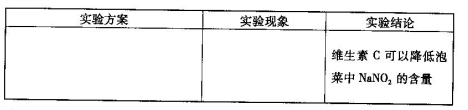
参考答案:
(1)分液漏斗?干燥
(2)3MnO4-+ 5NO +4H+ = 3Mn2++2H2O+5NO3-
(3) AB间加盛水的洗气瓶
(4)吸附悬浮物使滤液澄清
(5)120
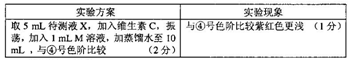
(6)
本题解析:(1)无水氯化钙具有吸水作用,做干燥剂;(2)高锰酸钾被还原为Mn2+(酸性条件),(3)产品纯度低的原因是A中反应会生成NO2,导致产品中含有NaNO3,所以需在AB间加盛水的洗气瓶除去NO2;(4)明矾在水溶液中水解形成胶体吸附悬浮物达到净水的作用;
(5)注意单位换算,稀释后待测溶液NaNO2的浓度为60mg/L,密度为1g/mL,;此泡菜样品中NaNO2的含量为60×0.01÷(5×10-3)=120mg·kg-1;(6)要控制实验的变量进行比较,所以浓度、温度等要与上述实验相同,并与标准色阶对比,颜色应浅于④号。
本题难度:一般
4、选择题 每个公民都应该有安全意识,今年频繁发生的有关化学品泄漏或爆炸事件一次又一次给我们敲响了警钟。下列做法存在安全隐患的是
[? ]
①将水沿着烧杯内壁缓缓加入浓硫酸中,并用玻璃棒不断搅拌;
②给试管中液体加热时,应将试管倾斜,与桌面成45°角,再集中在药品处加热;
③取用金属Na或K时,用剩的药品要放回原瓶;
④夜间厨房发生液化气(烷烃混合物)泄漏时,应立即开灯检查液化气泄漏原因,并打开所有门窗通风;
⑤废旧电池应回收处理。
A.全部?
B.①②④ ?
C.①③⑤ ?
D.①④⑤
参考答案:B
本题解析:
本题难度:简单
5、选择题 化工厂里运输浓硫酸的铝罐上经常贴有下列危险品标识,其中正确的是(?)
A.剧毒品
B.遇湿易燃物品
C.腐蚀品
D.有害品(远离食品)
参考答案:C
本题解析:略
本题难度:简单