时间:2020-08-13 06:50:23
1、选择题 下列物质中同时含有Cl2和Cl的是
A.液氯
B.新制氯水
C.氯化钠溶液
D.次氯酸钙
参考答案:B
本题解析:
本题难度:一般
2、选择题 下列事实可证明氨水是弱碱的是
A.氨水能被弱酸醋酸中和
B.铵盐受热易分解
C.氨水可以使酚酞试液变红
D.0.1mol / L氯化铵溶液的pH约为5
参考答案:D
本题解析:A和C只能说明氨水显碱性,铵盐的热稳定性和氨水的弱碱性是无关的。D中溶液显酸性,说明氯化铵水解显酸性,越弱越水解,因此氨水属于弱碱。答案选D。
本题难度:一般
3、选择题 碘单质在水溶液中溶解度很小,但在CCl4中溶解度很大,这是因为
[? ]
A.CCl4与I2相对分子质量相差较小,而H2O与I2相对分子质量相差较大
B.CCl4与I2都是直线形分子,而H2O不是直线形分子
C.CCl4和I2都不含氢元素,而H2O中含有氢元素
D.CCl4和I2都是非极性分子,而H2O是极性分子
参考答案:D
本题解析:
本题难度:一般
4、选择题 关于溶液的下列说法正确的是
A.c(H+):c(OH-)=1:10-2的溶液中K+、Ba2+、ClO-、CO32-一定能大量存在
B.水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-一定能大量存在
C.往0.1mol/LCH3COOH溶液中通人少量HCl,醋酸的电离平衡向逆反应方向移动,且溶液中增大
D.等物质的量浓度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3中c(CO32-)的大小关系为:②>④>③>①
参考答案:D
本题解析:试题分析:A、c(H+):c(OH-)=1:10-2的溶液显酸性,故与CO32-不能共存;B、由水电离产生的H+浓度为1×10-13mol?L-1的溶液,溶液为酸或碱溶液,酸性溶液中H+、NO3-、I-发生氧化还原反应,则不能共存;C、温度不变,电离常数不变;D.等物质的量浓度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3中c(CO32-)的大小关系为:②>④>③>①。
考点:离子共存,电力平衡常数,离子浓度大小比较。
本题难度:困难
5、选择题 向ZnSO4溶液中加入Na2S溶液时,得到白色沉淀,然后向白色沉淀中滴加CuSO4溶液,发现沉淀变为黑色,则下列说法不正确的是
A.白色沉淀为ZnS,黑色沉淀为CuS
B.上述现象说明ZnS的Ksp小于CuS的Ksp
C.利用该原理可实现一种沉淀转化为更难溶的沉淀
D.该过程破坏了ZnS的溶解平衡
参考答案:B
本题解析:ZnSO4+Na2S=ZnS↓+Na2SO4? ZnS+CuSO4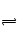 CuS+ZnSO4,A正确,先得到白色沉淀,后转化为黑色沉淀,C、D正确,B、不正确,ZnS的Ksp大于CuS的Ksp,CuS更难溶。
CuS+ZnSO4,A正确,先得到白色沉淀,后转化为黑色沉淀,C、D正确,B、不正确,ZnS的Ksp大于CuS的Ksp,CuS更难溶。
本题难度:困难