时间:2020-08-13 06:50:02
1、选择题 设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,11.2 L Cl2通入含0.5molFeBr2的溶液中转移电子数为1.5NA
B.0.1 mol·L-1的AlCl3溶液与足量NaOH溶液反应所得产物中含AlO2-为0.1NA
C.足量Zn与浓硫酸共热可生成标准状况下的气体2.24 L,则参加反应的硫酸为0.4 NA
D.常温常压下,5.6g环丙烷和聚乙烯的混合物中含有的碳原子数为0.4NA
2、填空题 实验室用密度为1.84g/cm3,溶质的质量分数为98%的硫酸,配制200mL物质的量浓度为0.46mol/L的硫酸.
(1)应量取98%的硫酸的体积为______mL.该试验中两次用到玻璃棒,其作用分别是______,______.
(2)使用容量瓶前必须进行的第一步操作是______.
(3)配制溶液时,一般可以分为以下几个步骤:
①称量?②计算?③溶解?④摇匀?⑤转移?⑥洗涤?⑦定容?⑧冷却
其正确的操作顺序为______.
3、选择题 2.16 g X2O5中含有0.1 mol氧原子,则X的相对原子质量为( )
A.21.6
B.28
C.14
D.31
4、选择题 下列说法中,正确的是 ( )
A.1 mol氧的质量是16g
B.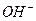 的摩尔质量是17g
的摩尔质量是17g
C.1 molH2O的质量是18g/mol
D.CO2的摩尔质量是44g/mol
5、选择题 用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.1 mol N2所含有的原子数为NA
B.标准状况下,22.4 L水中含有的水分子数为NA
C.标准状况下,22.4 L氯化氢所含的原子数为NA
D.32 g O2所含的氧原子数目为2NA