时间:2020-08-13 06:42:50
1、选择题 在容积固定的容器中发生反应:CO(g)+2H2(g) CH3OH(g)?△H<0,各物质的浓度如下表
CH3OH(g)?△H<0,各物质的浓度如下表
下列说法不正确的是(? )
A.2min-4min内用氢气表示的速率为0.3mol/(L?min)
B.达平衡时,CO的转化率为62.5%
C.反应在第2min时改变了条件,可能是加入了催化刺
D.反应在第2min时改变了条件,可能增加了H2的浓度
参考答案:D
本题解析:CO(g)? +? 2H2(g)? ?CH3OH(g)
?CH3OH(g)
初始c:? 0.8? 1.6? 0
△c1:? 0.2? 0.4? 0.2
2min时c:? 0.6? 1.2? 0.2
△c2:? 0.3?0.6? 0.3
4min时c:? 0.3? 0.6? 0.5
A:由公式可知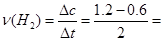 0.3mol/(L?min)
0.3mol/(L?min)
B:达平衡时α(CO)= =62.5%
=62.5%
C:反应开始至2min时与2min至4min相比,反应速率加快,可能是加入了催化剂;
D:比较2min与4min两状态下的反应混合物的物质的量浓度可知,如果在2min时增加氢气的浓度,4min时氢气的浓度不可能为0.6mol/L,故排除。
故答案为? D
本题难度:一般
2、填空题 (14分)加大对煤燃烧产生的废气、废渣的处理已刻不容缓。
(1) 对燃煤的废气进行脱硝处理时,可利用甲烷催化还原氮氧化物,如:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g);ΔH=a kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g);ΔH=b kJ·mol-1
则反应CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g)的ΔH=________ kJ·mol-1(用含a、b的代数式表示)。
(2) 将燃煤废气中的CO2转化为二甲醚的反应原理为: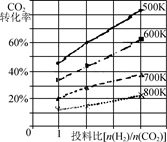
2CO2(g)+6H2(g)  CH3OCH3(g)+3H2O(g);ΔH
CH3OCH3(g)+3H2O(g);ΔH
① 该反应平衡常数表达式为K=________。
② 已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如右图所示。该反应的ΔH________(填“>”“<”或“=”)0。若温度不变,减小反应投料比[n(H2) /n(CO2)],则K将________(填“增大”“减小”或“不变”)。
③ 二甲醚燃料电池具有启动快,效率高等优点,若电解质为酸性,二甲醚燃料电池的负极反应为____________________________。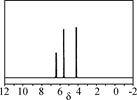
(3) 以CO2为原料合成的碳酸酯(仅含碳、氢、氧三种元素)是用途广泛的化学品,某种碳酸酯(DPC)水解产物之一遇氯化铁溶液显紫色,右图为它的核磁共振氢谱图,请写出DPC的结构简式:____________。
(4) 某电厂的粉煤灰含莫来石(主要成分为Al6Si2O13、SiO2)。将其和纯碱在高温下烧结,可制取NaAlSiO4(霞石)、Na2SiO3和NaAlO2,有关化学方程式(反应条件均为高温)为:
Al6Si2O13+3Na2CO3===2NaAlSiO4+4NaAlO2+3CO2↑
Al6Si2O13+5Na2CO3===2Na2SiO3+6NaAlO2+5CO2↑
SiO2+Na2CO3===Na2SiO3+CO2↑
则用1 mol Al6Si2O13和4 mol SiO2通过以上反应制得5 mol NaAlO2,共消耗Na2CO3为________mol。
参考答案:
(1) (a+b)/2
(2) ① [c(CH3OCH3)×c3(H2O)]/[c2(CO2)×c6(H2)] ② < 不变
③ CH3OCH3-12e-+3H2O===2CO2+12H+
(3) 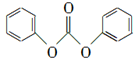 ?
?
(4) 8
本题解析:(1)方程式(1+2)÷2得到对应方程式,焓变同方程式,ΔH=(a+b)/2 kJ·mol-1(2)由图可知,温度高CO2转化率低,平衡逆向移动,反应放热;平衡常数只与温度有关,温度不变,k不变;负极是二甲醚失去电子,转移电子数可以根据化合价确定;(3)根据信息确定形成酯的酸为碳酸,提共羟基的为酚,产物只有3中不同化学环境的氢且比值为2:2:1,由此确定为 ;(4)反应中SiO2消耗Na2CO3,Al6Si2O13与Na2CO3发生两个反应,根据 反应物和产物列方程组解题,
;(4)反应中SiO2消耗Na2CO3,Al6Si2O13与Na2CO3发生两个反应,根据 反应物和产物列方程组解题,
设第1、2反应分别消耗Al6Si2O13的物质的量为x、y,则有
X+y=1
4x+6y=5
解得x=y=0.5mol
故共消耗Na2CO3为0.5×3+0.5×5+4=8mol
本题难度:一般
3、填空题 (6分)右图所表示在密闭容器中反应:2SO2(g)+O2(g)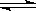 2SO3(g)ΔH<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a ~b过程中改变的条件可能是?;b ~c过程中改变的条件可能是?;若增大压强时,反应速度变化情况画在c~d处.
2SO3(g)ΔH<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a ~b过程中改变的条件可能是?;b ~c过程中改变的条件可能是?;若增大压强时,反应速度变化情况画在c~d处. 
参考答案:升高温度;降低SO3浓度。
本题解析:略
本题难度:简单
4、填空题 在298K时,合成氨反应N2(g)+3H2(g)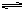 2NH3(g)△H =-92.2kJ/mol。在该条件下向一绝热的密闭的容器中加入1mol N2和3mol H2,使之充分反应,测得放出的热量总是小于92.2kJ,其主要原因是?。
2NH3(g)△H =-92.2kJ/mol。在该条件下向一绝热的密闭的容器中加入1mol N2和3mol H2,使之充分反应,测得放出的热量总是小于92.2kJ,其主要原因是?。
参考答案:该反应是可逆反应,1mol N2和3mol H2不能完全反应到底。
本题解析:由于该反应是可逆反应,结合可逆反应的特点:反应永远不能进行到底,得到测得放出的热量总是小于92.2kJ。
本题难度:简单
5、填空题 在密闭容器中,充入一定量的N2和H2,在一定条件下合成氨,若以v(H2)、v(N2)分别表示消耗速率,v(NH3)表示分解速率,那么,该反应达到平衡前,用“>”“<”或“=”表示下列关系:
(1)v(H2)____________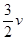 (NH3)。
(NH3)。
(2)v(H2)____________3(N2)。
参考答案:(1)>(2)=
本题解析:(1)反应达到平衡前,正反应速率大于逆反应速率,v(H2)>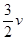 (NH3)。
(NH3)。
(2)v(H2)、v(N2)均表示正反应速率,无论是否达到平衡,v(H2)∶v(N2)=3∶1。
本题难度:简单