时间:2020-08-13 06:31:44
1、选择题 化学与科学、技术、环境密切相关。下列有关说法中正确的是
? [? ]
A.由石墨剥离而成的石墨烯属于烯烃
B.高纯硅是工业上制造光导纤维的主要原料
C.“赤潮”和“水华”均是水体富营养化引起的
D.“低碳生活”提倡绿色化学,告别含碳物质
参考答案:C
本题解析:
本题难度:简单
2、填空题 【化学—化学与技术】硫酸是一种重要的化工原料,硫酸工业的“三废”处理之一是对尾气处理,其中一种方法便是用天然海水进行尾气脱硫。
(1)硫酸工业生产的主要设备有?、?和吸收塔。在吸收塔内装有大量磁环的作用是?,浓硫酸从塔顶喷下,SO3吸收操作采取?形式(原理);硫酸工业的尾气主要成分有SO2、O2、N2等。
(2)天然海水主要含有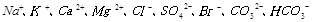 等离子。
等离子。
①天然海水pH约为8,原因是海水中?离子水解所致。
②尾气进入吸收塔内,塔顶喷下大量海水,O2能将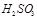 、
、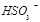 、
、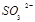 等氧化,试写出其中一个反应的方程式:?。
等氧化,试写出其中一个反应的方程式:?。
③向氧化后的海水中加入天然海水,其目的是中和、稀释氧化后海水中生成的酸,最终排放出的海水中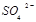 浓度与进入吸收塔的天然海水相比,
浓度与进入吸收塔的天然海水相比,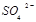 浓度?(填序号)。
浓度?(填序号)。
A.减少
B.增大
C.不变
D.无法判断
参考答案:(8分)
(1)沸腾炉、转换器(接触室);增大吸收(接触)面积;?逆流
(2)①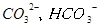
②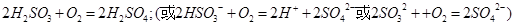
③B
(每空1分)
本题解析:(1)硫酸工业生产的主要设备有沸腾炉、接触室和吸收塔
在吸收塔内装有大量磁环的作用是增大吸收(接触)面积
浓硫酸从塔顶喷下,SO3吸收操作采取逆流形式
(2)①天然海水pH约为8,原因是海水中CO32-、HCO3-所致
②任意一个方程式:2H2SO3+O2=2H2SO4
③SO42-浓度增大,故选B
本题难度:一般
3、选择题 绿色化学提倡化工生产应提高原子利用率。在下列制备环氧乙烷的反应中,原子利用率最高的是
[? ]
A.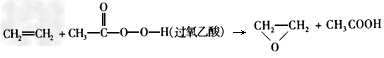
B.CH2=CH2+Cl2+Ca(OH)2→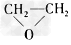 +CaCl2+H2O
+CaCl2+H2O
C.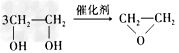 + HOCH2CH2-O-CH2CH2OH+2H2O
+ HOCH2CH2-O-CH2CH2OH+2H2O
D.2CH2=CH2?+?O2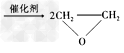 ?
?
参考答案:D
本题解析:
本题难度:简单
4、选择题 城市的环境污染是当前突出的环境问题。如图A所示,X河流经某工业城市Y,其中a处在上游,附近有丰富的黄铁矿资源;d处在下游,附近有多个企业以硫酸为原料。根据某月Y市环保局监测站对X河水质检测的结果,绘制成简图如图B所示。下列说法不正确的是(? )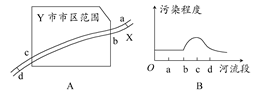
A.造成X河污染的主要污染源最可能分布在bc段
B.工业生活污水、固体废弃物等可能是造成X河污染的污染源
C.d处污染程度减小,可能是某些污染物的离子间发生反应生成沉淀所致
D.该城市建设硫酸厂时,综合考虑诸多因素选址在b处最合理
参考答案:D
本题解析:由于bc段污染程度呈上升趋势,则bc段是产生污染的地区,cd段逐渐下降,说明污染的物质之间发生化学反应,以气体或沉淀的形式析出,河水污染程度降低。由于b处是市区用水的上游,硫酸厂应选在河水的下游。
本题难度:一般
5、填空题 一工厂用软锰矿(含MnO2约70%及Al2O3)和闪锌矿(含ZnS约80%及FeS)共同生产MnO2和Zn(干电池原料):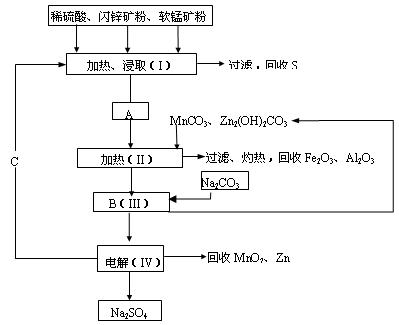
已知① A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液。
② IV中的电解反应式为MnSO4+ZnSO4+2H2OMnO2+ Zn+2H2SO4。
(1)A中属于还原产物的是___________。
(2)MnCO3、Zn2(OH)2CO3的作用是_____________________________;II需要加热的原因是___________;C的化学式是____________。
(3)该生产中除得到MnO2和Zn以外,还可得到的副产品是______________。
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是___________。
(5)要从Na2SO4溶液中得到芒硝(Na2SO4·10H2O),需进行的操作有蒸发浓缩、________、过滤、洗涤、干燥等。
(6)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿的质量比大约是__________。
参考答案:
(1)MnSO4?
(2)增大溶液的pH,使Fe3+和 Al3+生成沉淀;
使形成胶体的氢氧化铝和氢氧化铁也生成沉淀; H2SO4
(3)Fe2O3、Al2O3、S?(4)纯碱、H2SO4?(5)降温结晶?(6)1.03(或1)
本题解析:略
本题难度:简单