时间:2020-08-13 06:31:03
1、选择题 铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如下。
下列说法不正确的是
A.因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀
B.若水膜中溶解了SO2,则铁铆钉腐蚀的速率变小
C.铜极上的反应是2H+ + 2e- ="=" H2↑,O2 + 4e- + 4H+ ="=" 2H2O
D.在金属表面涂一层油脂,能防止铁铆钉被腐蚀
2、选择题 下列变化需要通电才可以进行的是
①电离?②电解?③电镀?④电化学腐蚀
A.①②③
B.②③④
C.②③
D.全部
3、选择题 下列说法正确的是(?)
A.用惰性电极电解饱和氯化钠溶液的总反应为:2Cl- + 2H+ H2↑+ Cl2↑
H2↑+ Cl2↑
B.锌铜原电池中盐桥中的阴离子移向ZnSO4溶液
C.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
D.电镀时,镀层金属作阳极;精炼铜时,用纯铜作阴极
4、选择题 用铅蓄电池(总反应:Pb+PbO2+4H++ 2SO
2SO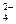
 2PbSO;+2H2O电解苦卤水(含C1一、Br一、Na+、Mg2+)的装置如图所示(a、b为石墨电极)。下列说法中正确的是?(?)
2PbSO;+2H2O电解苦卤水(含C1一、Br一、Na+、Mg2+)的装置如图所示(a、b为石墨电极)。下列说法中正确的是?(?)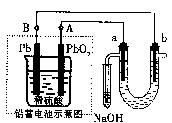
A.铅蓄电池放电时的正极反应是:PbO2+4H++SO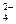 =PbSO4+2H2O
=PbSO4+2H2O
B.电解苦卤水时,a电极首先放电的是Br一而不是Cl一,说明当其它条件相同时Br一的还原性强于Cl—
C.铅蓄电池充电时,A极应与外接电源负极相连
D.忽略能量消耗,当b极产生0.02g气体时,铅蓄电池中消耗0.01 tool H2SO4
5、选择题 钢铁在潮湿的空气中会形成原电池而被腐蚀,下列说法正确的是( )
A.钢铁设备上连接铜块可以防止腐蚀
B.原电池的正极反应为:O2+2H20+4e-═40H-
C.原电池的负极反应为:Fe→Fe3++3e-
D.钢铁与外加直流电源的正极相连可以防止腐蚀