时间:2020-08-13 06:31:03
1、选择题 下列事实解释准确的是
A.糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。脱氧过程中铁作原电池正极,电极反应为:Fe-2 e-=Fe2+
B.酸性氢氧燃料电池的正极电极反应为:2H2O+O2+4e-=4OH-
C.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,该反应的△S>0,说明反应△H>0
D.铅蓄电池的正极反应为:PbO2+4H++2 e-=Pb2++2H2O
参考答案:C
本题解析:A、原电池中较活泼的金属做负极,铁是活泼的金属,因此脱氧过程中铁作原电池负极,电极反应为:Fe-2e=Fe2+,A不正确;B、酸性氢氧燃料电池的正极电极反应为:4H++O2+4e-=2H2O,B不正确;C、CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,该反应的△S>0,则根据△G=△H-T·△S可知,该反应的△H>0,C正确;D、铅蓄电池中的电解质溶液是稀硫酸,因此正极反应为:PbO2+4H++SO42-+2 e-=PbSO4+2H2O,D不正确,答案选C。
本题难度:一般
2、选择题 下列关于金属腐蚀的叙述中正确的是( )
A.常温下放置在空气中的金属主要发生的是析氢腐蚀
B.马口铁(镀锡层)镀层破损后被腐蚀时,首先是镀层被氧化
C.钢铁在干燥的氯气中发生电化腐蚀而生锈
D.外接电流的阴极保护法防腐效果要比牺牲阳极的阴极保护法好
参考答案:A、金属的腐蚀有吸氧腐蚀和析氢腐蚀两类,当电解质溶液呈中性或碱性时发生吸氧腐蚀,当电解质溶液呈酸性时发生析氢腐蚀,故A错误;
B、铁比锡活泼,易做原电池的负极而被氧化,故B错误;
C、在干燥的环境中不能形成原电池,不能发生电化学腐蚀,故C错误;
D、金属连接电源负极时,氧化剂直接从电源得到电子,而防止金属被氧化,而如果用牺牲阳极的阴极保护法,当阴极金属为金属合金时,也会发生腐蚀,效果不如外接电流的阴极保护法,故D正确.
故选D.
本题解析:
本题难度:一般
3、选择题 对如图所示的实验装置的判断中错误的是?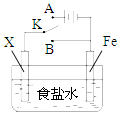
A.若X为碳棒,开关K置于A处可减缓铁的腐蚀
B.若X为锌棒,开关K置于A或B处均可减缓铁的腐蚀
C.若X为锌棒,开关K置于B处时,为牺牲阳极的阴极保护法
D.若X为碳棒,开关K置于B处时,
碳棒上发生的反应为2H++2e-=H2↑?
参考答案:D
本题解析:若开关K置于A处时,装置形成电解池,其中X为阳极,Fe为阴极,阴极被保护,可减缓铁的腐蚀,所以A正确,方程式为NaCl + H2O 电解 H2↑+ Cl2↑+ NaOH,若将开关置于B处时,装置形成原电池,当X为锌棒时,X为正极,Fe为负极,正极被保护,为牺牲阳极的阴极保护法,可减缓铁的腐蚀,所以B、C正确;当X为碳棒时,X为正极,Fe为负极,负极:Fe - 2e- = Fe2+,正极:O2 + 2H2O + 4e- = 4OH-故选D。
本题难度:一般
4、选择题 下列有关金属腐蚀与防护的说法正确的是
[? ]
A.纯银器表面在空气中因化学腐蚀渐渐变暗
B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
参考答案:AC
本题解析:
本题难度:简单
5、简答题 人类的生活离不开化学,生活中的化学无处不在.请回答:
(1)家用铁锅用水清洗后放置一段时间,出现红棕色的锈斑.此过程中不可能发生的变化有______(填序号).
①铁元素被氧化②铁元素被还原③铁元素由+3价转化为+2价
为防止铁锅生锈,将其洗净后,可进一步采取的措施是______(填序号).
①擦干②放在潮湿的地方
(2)抗酸药物的作用是中和胃里过多的盐酸.某抗酸药的主要成分是碳酸氢钠,写出碳酸氢钠与盐酸反应的离子方程式:______.若此抗酸药每片含碳酸氢钠0.40g,取此药一片研碎后与足量的盐酸反应,生成气体在标准状况下的体积为______L(精确到0.01).
参考答案:(1)铁锅中含有碳、铁,碳、铁和合适的电解质溶液构成原电池,较活泼的金属铁作负极,碳作正极,铁失电子发生氧化反应,氧气得电子发生还原反应,亚铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁不稳定被氧气氧化生成氢氧化铁,所以不可能发生的变化是②③,为防止形成原电池,要擦干,故选①;
故答案为:②③,①;
(2)碳酸氢钠和盐酸反应的离子方程式为:HCO3-+H+=C02↑+H2O,
根据HCO3-+H+=C02↑+H2O知,生成二氧化碳的体积=0.4g84g/mol×22.4L/mol=0.11L,
故答案为:HCO3-+H+=C02↑+H2O,0.11.
本题解析:
本题难度:简单