时间:2020-08-13 06:11:32
1、选择题 下列装置的线路接通后,经过一段时间,溶液的pH明显下降的是()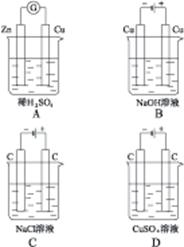
参考答案:D
本题解析:A为原电池,反应式为:Zn+H2SO4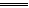 ZnSO4+H2↑,c(H+)下降,pH上升。B、C、D均为电解池,反应式依次为:Cu+2H2O
ZnSO4+H2↑,c(H+)下降,pH上升。B、C、D均为电解池,反应式依次为:Cu+2H2O Cu(OH)2↓+H2↑、2NaCl+2H2O
Cu(OH)2↓+H2↑、2NaCl+2H2O 2NaOH+H2↑+Cl2↑、2CuSO4+2H2O
2NaOH+H2↑+Cl2↑、2CuSO4+2H2O 2Cu+2H2SO4+O2↑,则B中水减少,c(NaOH)上升、c(OH)-上升、pH上升;C中产生NaOH、pH上升;D中产生H2SO4,pH下降。故选择D选项。
2Cu+2H2SO4+O2↑,则B中水减少,c(NaOH)上升、c(OH)-上升、pH上升;C中产生NaOH、pH上升;D中产生H2SO4,pH下降。故选择D选项。
本题难度:简单
2、选择题 钢铁发生吸氧腐蚀时,正极上发生的电极反应是
A.2H++2e-=H2
B.Fe2++2e-=Fe
C.2H2O+O2+4e-=4OH-
D.Fe3++e-=Fe2+
参考答案:C
本题解析:原电池中负极失去电子,发生氧化反应;正极得到电子,发生还原反应。所以钢铁的吸氧腐蚀中,铁是负极,氧气在正极得到电子,答案选C。
本题难度:一般
3、选择题 一种充电池放电时的电极反应为H2+2OH--2e-=2H2O;NiO(OH)+ H2O + e-=Ni(OH)2+ OH-,当为电池充电时,与外电源正极连接的电极上发生的反应是
A.H2O的还原
B.Ni(OH)2的还原
C.H2的氧化
D.Ni(OH)2的氧化
参考答案:D
本题解析:略
本题难度:简单
4、选择题 铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法正确的是( )
A.正极电极反应式为:2H++2e-=H2↑
B.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.此过程中Fe、Cu均被腐蚀
D.此过程中电流从Fe移向Cu
参考答案:根据图片知,水中溶解了氧气,铜、铁和水构成了原电池,较活泼的金属作负极,较不活泼的金属作正极,发生吸氧腐蚀.
A、正极上氧气得电子发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-,故A错误;
B、负极上发生的电极反应式为:Fe-2e-=Fe2+,正极上的电极反应式为:O2+2H2O+4e-=4OH-,亚铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁不稳定,容易被空气中的氧气氧化生成氢氧化铁,反应方程式为:4Fe(OH)2+2H2O+O2=4Fe(OH)3,故B正确;
C、该原电池中铜作正极,原电池放电时,负极失电子容易被腐蚀,正极被保护,所以铜不被腐蚀,故C错误;
D、该原电池放电时,外电路上电子从负极铁流向正极铜,电流从Cu移向Fe,故D错误;
故选B.
本题解析:
本题难度:一般
5、选择题 有关金属腐蚀与防护的叙述中正确的是
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.镀锡铁制品和镀锌铁制品的的镀层破损时,镀锡层的铁更耐腐蚀
C.在闸门上连接锌块保护闸门不受腐蚀是采用了牺牲阳极保护法
D.银奖牌与硫磺混在一起会变黑是电化学腐蚀所致
参考答案:AC
本题解析:本题考查金属的腐蚀。铜锌合金形成的原电池中,锌作负极,铜做正极,A选项正确;在金属活动性顺序表中:锌>铁>锡,所以镀锡铁制品中铁做负极,更加容易腐蚀,B选项错误;银奖牌与硫磺混在一起会变黑是因为发生了反应2Ag+S=Ag2S,D选项错误。
本题难度:一般