时间:2020-08-13 05:54:15
1、选择题 下列关于强、弱电解质的叙述中,正确的是(?)
A.强电解质都是离子化合物,弱电解质都是共价化合物
B.强电解质都是可溶性化合物,弱电解质都是难溶性化合物
C.强电解质熔化时都完全电离,弱电解质在水溶液中部分电离
D.强电解质不一定能导电,弱电解质溶液的导电能力不一定比强电解质弱
参考答案:D
本题解析:略
本题难度:简单
2、填空题 (12分) 常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题: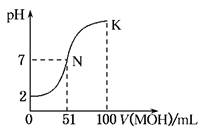
(1)由图中信息可知HA为________酸(填“强”或“弱”),理由是____________(2分)
(2)常温下一定浓度的MA稀溶液的pH=a,则a________7(填“>”、“<”或“=”),用离子方程式表示其原因为__________________________;,此时,溶液中由水电离出的c(OH-)=________。(4分)
(3)请写出K点所对应的溶液中离子浓度的大小关系:__________?(2分)
(4)K点对应的溶液中,c(M+)+c(MOH)________2c(A-)(填“>”、“<”或“=”);若此时溶液中,pH=10,则c(MOH)+c(OH-)=________mol·L-1。(4分)
参考答案:(1)强 0.01 mol·L-1HA的pH为2,说明HA完全电离
(2)< M++H2O?MOH+H+,1×10-amol·L-1,(3)c(M+)>c(A-)>c(OH-)>c(H+),(4)= 0.005
本题解析:此题为关于溶解度曲线的题目,首先要看清曲线:起点(强酸弱酸、强碱弱碱),曲线平滑、滴定终点、pH=7的点等等。(1)因为浓度0.01mol/L,pH=2,故该酸为一元强酸;(2)V=50ml滴定终点时,pH<7,为强酸弱碱盐,水解为酸性。故该碱为弱碱,M++H2O MOH+H+,促进水的电离c(OH-)=1×10-amol·L-1;(3)K点为MA和MOH的混合溶液,故离子浓度大小关系为c(M+)>c(A-)>c(OH-)>c(H+),(4)根据物料守恒,c(A-)+c(HA)=0.1L×0.01mol/L=0.001mol,c(M+)+c(MOH)= 0.1L×0.02mol/L=0.002mol;故有c(M+)+c(MOH)=2[c(A-)+c(HA)]> 2c(A-)
MOH+H+,促进水的电离c(OH-)=1×10-amol·L-1;(3)K点为MA和MOH的混合溶液,故离子浓度大小关系为c(M+)>c(A-)>c(OH-)>c(H+),(4)根据物料守恒,c(A-)+c(HA)=0.1L×0.01mol/L=0.001mol,c(M+)+c(MOH)= 0.1L×0.02mol/L=0.002mol;故有c(M+)+c(MOH)=2[c(A-)+c(HA)]> 2c(A-)
本题难度:一般
3、选择题 在室温下,等体积的酸和碱的溶液混合后,pH一定小于7的是
A.pH=3的HNO3跟pH=11的KOH
B.pH=3的盐酸跟pH=11的氨水
C.pH=3的醋酸跟pH=11的Ba(OH)2
D.pH=3硫酸跟pH=11的NaOH
参考答案:C
本题解析:A.硝酸和氢氧化钡都是强电解质,pH=3的硝酸和pH=11的Ba(OH)2溶液中,硝酸中氢离子浓度等于氢氧化钡溶液中氢氧根离子浓度,二者等体积混合时恰好反应生成硝酸钡,溶液呈中性,故A错误;B.氯化氢是强电解质,一水合氨是弱电解质,所以pH=3的盐酸和pH=11的氨水,盐酸的浓度小于氨水浓度,二者等体积混合,氨水有剩余,一水合氨的电离程度大于铵根离子的水解程度,所以混合溶液呈碱性,故B错误;醋酸是弱电解质,氢氧化钾是强电解质,所以pH=3的醋酸和pH=11的KOH溶液,醋酸溶液浓度大于氢氧化钾溶液,二者等体积混合时,醋酸有属于,醋酸的电离程度大于醋酸根离子水解程度,所以混合溶液呈酸性,故C正确;硫酸和氢氧化钠都是强电解质,pH=3的硫酸中氢离子浓度为0.001mol/L,pH=11的KOH溶液中氢氧根离子浓度为0.001mol/L,等体积混合,二者恰好反应生成硫酸钾,混合溶液呈中性,故D错误;故选C。
考点:酸碱混合时pH的计算
本题难度:一般
4、选择题 25℃时,有关弱酸的电离平衡常数如下:下列有关说法正确的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 电离平衡常数(25℃) 1.8×10-5 4.9×10-10 K1=4.3×10-7K2=5.6×10-11 |
参考答案:A、根据电离平衡常数可知酸性强弱顺序为:CH3COOH>HCN>HCO3-,酸性越弱,对应钠盐中酸根离子水解程度越大,溶液的PH越大,物质的量浓度的各溶液pH关系为:
pH(Na2CO3)>pH(NaCN)>pH(CH3COONa),故A错误;
B、如c(Na+)>c(CN-),根据溶液电中性可知c(H+)<c(OH-),溶液呈碱性,a<b或a═b都符合,故B错误;
C、冰醋酸属于弱电解质,加水促进电离,冰醋酸中逐滴加水,溶液的导电性先增大后减小,pH先减小后增大,醋酸的电离程度逐渐增大,故C错误;
D、Na2CO3和NaHCO3等物质的量混合溶液中,存在的阳离子有Na+、H+,阴离子有OH-、HCO3-、CO32-,根据溶液电中性,存在C(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故D正确;
故选D.
本题解析:
本题难度:简单
5、选择题 下列溶液中微粒浓度关系一定正确的是(?)
A.常温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+)
B.常温下,pH=2的一元酸和pH=12的一元强碱等体积混合: c(OH-)=c(H+)
C.0.1 mol·L—1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)
D.0.1 mol·L—1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
参考答案:C
本题解析:A、氨水与氯化铵混合溶液中的电荷守恒式为:c(NH4+)+c(H+)= c(Cl-)+ c(OH-),常温下, pH=7溶液呈中性,c(OH-)=c(H+),则c(Cl-)=c(NH4+),错误;B、常温下,pH=2的一元强酸和pH=12的一元强碱等体积混合: c(OH-)=c(H+),常温下,pH=2的一元弱酸和pH=12的一元强碱等体积混合: c(OH-)<c(H+),错误;C、0.1 mol·L—1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+),正确;D、硫化钠溶液中质子守恒式为:c(OH-)=c(H+)+c(HS-)+2c(H2S),错误。
本题难度:一般