时间:2020-08-13 05:44:35
1、选择题 物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液的体积比为3∶2∶1时,三种溶液中Cl—的物质的量之比为(?)
A.1∶1∶1
B.1∶2∶3
C.3∶2∶1
D.3∶4∶3
2、选择题 设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.1 mol溴苯中含有双键的数目为0.3NA
B.0.1 mol/L醋酸溶液中含有醋酸分子的数目为0.1 NA
C.5.6g Fe与足量的水蒸气完全反应,转移电子的数目为0.2NA
D.标准状况下,11.2L 由H2和CO组成的混合气体中含有分子的数目为0.5NA
3、选择题 体积为V mL,密度为d g/ml,溶质的摩尔质量为M g·mol-1,物质的量浓度为c mol·L-1,溶质的质量分数为a%,溶质的质量为m g。下列式子正确的是
A.m = aV/100d
B. c = 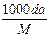
C.c = 
D. a% =  %
%
4、选择题 下列说法正确的是
[? ]
A.摩尔是七个基本物理量之一
B.阿伏加德罗常数是没有单位的
C.氮气的摩尔质量是28g
D.1molH2O约含有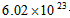 个水分子
个水分子
5、选择题 设NA代表阿伏加德罗常数的值,下列说法正确的是(? C 12? O 16? Fe 56 )?
A.28 gCO和16gO2所含的氧原子数都为NA
B.100mL 0.1 mol·L-1 AlCl3溶液中Al3+总数为0.01NA
C.标准状况下,22.4L CO2和O2的混合气体含有的分子总数为NA
D.5.6g Fe与足量Cl2反应时转移电子总数为0.2NA