时间:2020-08-13 05:38:49
1、选择题 在反应3BrF3+5H2O====HBrO3+Br2+9HF+O2↑中,若有3 mol水作还原剂时,被水还原的BrF3的物质的量为(?)
A.3 mol
B.2 mol
C. mol
mol
D. mol
mol
2、填空题 由于NaNO2有毒,将含该物质的废水直接排放会引起水体的严重污染,所以这种废水必须经处理后才能排放。处理方法之一的原理如下: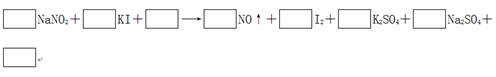 ?
?
(1)请完成并配平该化学方程式。
(2)在上述反应中,若要生成50.8 g I2,则电子转移了________个。
(3)用上述反应来处理NaNO2并不是最佳方法,其原因是
________________________________________________________________________。
从环保角度来讲,要处理NaNO2,所用物质的________(填“还原性”或“氧化性”)应该比KI更______(填“强”或“弱”)。
3、填空题 印刷电路板是由塑料和铜箔复合而成,刻制印刷电路时要用FeCl3溶液作为“腐蚀液”生成CuCl2和FeCl2,其反应的化学方程式如下: Cu + 2 FeCl3 === CuCl2 + 2 FeCl2
(1)请用双线桥法在上式中标出电子转移的情况
(2)此反应中的氧化剂是__________
(3)写出此反应的离子方程式:____________
(4)试比较Fe3+、Cu2+、Fe2+氧化性的强弱:__________ >__________ >_________
4、计算题 写出符合下列条件的氧化还原反应方程式
A.一种单质氧化另一种单质
B.一种单质氧化一种化合物
C.一种化合物氧化另一种化合物
D.一种化合物氧化一种单质
5、选择题 下列有关硫化亚铁跟浓硫酸反应的方程式正确的是()
A.2FeS+6H2SO4=Fe2(SO4)3+3SO2↑+2S+6H2O
B.4FeS+18H2SO4=2Fe2(SO4)3+9SO2↑+7S+18H2O
C.6FeS+16H2SO4=3Fe2(SO4)3+6SO2↑+7S+16H2O
D.8FeS+18H2SO4=4Fe2(SO4)3+3SO2↑+11S+18H2O