时间:2020-08-13 05:37:15
1、选择题 下列实验方案中,合理的是
A.可用生石灰除去乙酸中少量水
B.用5?mL苯与1mL浓溴水反应(Fe粉作催化剂)制溴苯
C.向适量浓硝酸、浓硫酸的混合物中逐滴加入苯,在50-60℃的水浴中加热以制取硝基苯
D.将2.5g?苯酚、2.5mL40%的甲醛溶液混合,沸水浴加热制酚醛树脂
2、简答题 接触法制硫酸是目前工业上生产硫酸的主要方法.请回答下列问题:
(1)工业上用此方法生产硫酸时,需要的主要原料有空气、______、98.3%的硫酸.
(2)在生产过程中产生的尾气必须进行净化处理,这样既可以将SO2再用于生产SO3,又可______.生产中常用Na2SO3溶液处理SO2尾气,步骤如下:第1步,用亚硫酸钠溶液吸收SO2生成亚硫酸氢钠;第2步,加热吸收液,使之重新生成亚硫酸钠,同时得到______副产品.
3、简答题 某厂为综合利用生产废料石膏(CaSO4?2H2O),设计如下工艺流程制备硫酸和生石灰.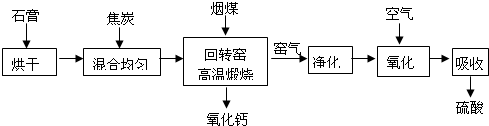
回答下列问题:
(1)窑气中除含有CO2外,还含有的主要物质是______.
(2)窑气经净化后在氧化、吸收过程中发生反应的化学方程式为______.
(3)回转窑内焦炭与硫酸钙反应的化学方程式为______.
(4)此硫酸产品经处理后得到的超纯硫酸是一种非常有效的清洗剂.一定条件下,它几乎可以除去硅晶片上所有的无机残留物与金属颗粒,除去硅晶片上铜颗粒的化学方程式为______.
4、选择题 对下列事实的解释正确的是
A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B.浓硫酸和浓盐酸混合可制氯化氢,说明浓硫酸是一种难挥发的酸
C.常温下,浓硫酸可以用铝罐贮存,说明铝与浓硫酸不反应
D.反应CuSO4+H2S→CuS↓+H2SO4能进行,说明硫化铜既不溶于水,也不溶于稀硫酸
5、选择题 下列实验设计能完成或实验结论合理的是
A.证明一瓶红棕色气体是溴蒸气还是二氧化氮,可以用湿润的碘化钾-淀粉试纸检验,观察试纸颜色的变化
B.测氯水的pH,可以用玻璃棒蘸取氯水点在干燥的pH试纸上,待其变色后和标准比色卡对照
C.铁钉放在浓硝酸中浸泡后,再用蒸馏水冲洗,然后放入CuSO4溶液中不反应,说明铁钉表面形成了一层致密稳定的氧化膜
D.向某溶液中加入稀盐酸,能产生使澄清石灰水变浑浊的气体,说明该溶液中一定含有CO32-