时间:2020-08-13 05:34:57
1、选择题 下列关于物质性质变化的比较,不正确的是
[? ]
A.酸性强弱:HIO4>HBrO4>HClO4
B.原子半径大小:Na>S>O
C.碱性强弱:KOH>NaOH>LiOH
D.金属性强弱:Ca>Mg>Al
参考答案:A
本题解析:
本题难度:一般
2、选择题 下列实验最终能看到白色沉淀的是
A.CO2或SO2通入CaCl2溶液中
B.过量CO2通入澄清石灰水中
C.过量SO2通入Ba(OH)2溶液中
D.过量CO2通入Na2SiO3溶液中
参考答案:D
本题解析:A中反应不能发生;B中CO2过量,生成的是碳酸氢钙;C中SO2过量生成的是亚硫酸氢钡;D中碳酸的酸性强于硅酸的,所以有硅酸白色沉淀产生,答案选D。
点评:本题基础性强,难度不大,但容易错选A。该题重点考查学生对常见元素及其化合物的性质,学生只要能熟练记住有关物质的化学性质,然后灵活运用即可得出。
本题难度:简单
3、选择题 四种主族元素的离子aXm+、bYn+、cZn-、dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,则下列关系能够成立的是
A.原子序数:a>b>c>d
B.a-b=n-m
C.元素非金属性:Z
参考答案:A
本题解析:
本题难度:困难
4、选择题 如图是元素周期表的一部分,关于图中阴影部分元素的说法中,正确的是( )
A.N元素为第一周期元素
B.PH3的稳定性比H2S强
C.该纵行元素的最高价氧化物对应的水化物化学式均为H3RO4
D.H3AsO4的酸性比H3PO4弱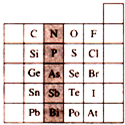
参考答案:A、N元素在元素周期表中第二周期,故A错误;
B、P的非金属性小于S的非金属性,则PH3的稳定性比H2S弱,故B错误;
C、该纵行元素的最高价氧化物对应的水化物化学式多为H3RO4,但N元素的最高价氧化物对应的水化物化学式多为HNO3,故C错误;
D、因非金属性As<P,则H3AsO4的酸性比H3PO4弱,故D正确;
故选D.
本题解析:
本题难度:一般
5、选择题 下列各化合物中,阴离子半径与阳离子半径之比最大的是
A.LiBr
B.KF
C.KBr
D.NaCl
参考答案:A
本题解析:使r(阴离子)最大,且使r(阳离子)最小,必满足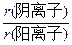 最大。观察备选项可知阴离子中r(Br--)最大,阳离子中r(Li+)最小,所以
最大。观察备选项可知阴离子中r(Br--)最大,阳离子中r(Li+)最小,所以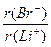 最大。
最大。
本题难度:一般