时间:2020-08-13 05:29:18
1、填空题 某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积KW=?。在此温度下,将 pH = a的 NaOH 溶液 Va L 与 pH = b的 H2SO4溶液 Vb L 混合。
(1)若所得混合液为中性,且 a= 12,b= 2,则 Va∶Vb=?;
(2)若所得混合液为中性,且 a+ b= 12,则 Va∶Vb=?;
(3)若所得混合液的 pH = 10,且 a= 12,b= 2,则 Va∶Vb=?。
2、选择题 “优化结构、提高效益和降低消耗、保护环境”,这是我国国民经济和社会发展的基础性要求。你认为下列说法不正确的是
A.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
B.将煤转化成气体燃料可以有效地减少引起“温室效应”的气体的产生
C.研制开发以水代替有机溶剂的化工涂料
D.加快太阳能、风能、生物质能、海洋能等清洁能源的开发利用
3、选择题 水的电离平衡曲线如图所示,下列说法不正确的是?(?)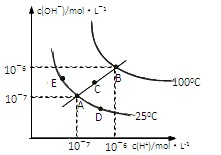
A.图中五点KW间的关系:B>C>A=D=E
B.若从A点到D点,可采用:温度不变在水中加入少量的酸
C.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性
D.若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl 固体的变化
4、计算题 (10分)Ba2+是一种重金属离子,某环境监测小组欲利用Na2S2O3、KI、K2Cr2O7等试剂测定某工厂废水中Ba2+的浓度。
(1)现需配制250mL0.100mol·L—1标准Na2S2O3溶液,所需要的玻璃仪器除量筒、250mL容量瓶、玻璃棒外,还需要?。
(2)需准确称取Na2S2O3固体的质量为?g。
(3)另取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉 淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液反应,反应液中再滴加上述Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。已知有关的离子方程式为:
淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液反应,反应液中再滴加上述Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。已知有关的离子方程式为:
①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;
②I2+2S2O32-=2I-+S4O62-。
试计算该工厂废水中Ba2+的物质的量浓度。(写出具体计 算过程)
算过程)
5、选择题 下列溶液中,微粒浓度关系正确的是(?)
A.含NH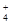 、Cl-、H+、OH-的溶液,其离子浓度一定是:c(Cl-)>c(NH+4)>c(H+)>c(OH-)
、Cl-、H+、OH-的溶液,其离子浓度一定是:c(Cl-)>c(NH+4)>c(H+)>c(OH-)
B.pH=7的氨水与氯化铵的混合溶液中,Cl-与NH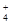 的浓度关系:c(Cl-)>c(NH
的浓度关系:c(Cl-)>c(NH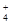 )
)
C.0.1 mol·L-1的Na2S溶液中粒子浓度关系:c(OH-)=c(HS-)+2c(H2S)+c(H+)
D.pH=3的一元酸和pH=11的一元强碱等体积混合:c(OH-)=c(H+)