时间:2020-08-13 05:13:42
1、实验题 (20分)用18.4mol·L-1的浓硫酸,配制 100 ml 1.0 mol·L-1的稀硫酸,请回答以下问题:
(1)需要18.4mol·L-1的浓硫酸 ml。
(2)下列哪组仪器在配制时不需要用到 ( )
①托盘天平 ②分液漏斗 ③250ml容量瓶 ④烧杯 ⑤胶头滴管
⑥量筒 ⑦玻璃棒⑧铁架台(带铁夹) ⑨100ml容量瓶
A.③④⑤⑦⑨ B.①②⑤⑥⑧ C.①②③⑧ D.③④⑤⑥
(3)下列实验步骤中,正确的操作顺序应该是:
A 用量筒量取浓硫酸,缓缓倒入装有约50ml蒸馏水的烧杯里,并用玻璃棒搅拌。
B 用约30ml蒸馏水,分出三次洗涤烧杯和玻璃棒,将每次洗涤液都倒入容量瓶中;
C 将稀释后的硫酸小心地倒入容量瓶中;
D.检查100ml容量瓶瓶口是否有漏液现象;
E.将蒸馏水直接加入容量瓶,至液面接近刻度线1——2cm处;
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液;
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,至液面最低点与刻度线相切;
(4)进行A步骤操作的时候,应该选用
①10 ml量筒 ②50 ml量筒 ③5000 ml量筒 ④1000 ml量筒
(5)进行A步操作后,必须 后,才能进行C步操作。
参考答案:(1)5.4
(2)C
(3)D A C B E G F
(4)1
(5)等溶液冷却至室温
本题解析:(1)①密度ρ=1.84g?mL-1,质量分数为98%的浓硫酸的浓度为:c=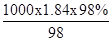 =18.4mol/L
=18.4mol/L
配制100mL1mol?L-1的稀硫酸,需要该浓硫酸的体积为: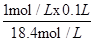 ≈0.0054L=5.4ml,答案:5.4;
≈0.0054L=5.4ml,答案:5.4;
(2)配制100mL1mol/L的稀硫酸的步骤为:计算→量取→稀释、冷却→移液→定容→摇匀→装瓶→贴
签,需要使用的仪器有:烧杯 、量筒 、100mL容量瓶、玻璃棒、定容时必须使用胶头滴管,所以还缺
少的仪器为胶头滴管,不要用到的是①②③⑧,答案选C;
实验过程中先检查容量瓶是否漏液,然后根据计算→量取→稀释、冷却→移液→定容→摇匀→装
瓶→贴签得步骤配置溶液,答案为DACGEBF;
通过计算需要浓硫酸5.4ml,根据选取量筒“大而近”的原则,应选用10ml的量筒,答案选①;
(5)若未冷却到室温即倒入容量瓶中,会使配置硫酸的浓度偏大,答案等溶液冷却到室温;答案:等
溶液冷却至室温
本题难度:一般
2、选择题 用36.5%的浓盐酸(密度1.2 g·cm-3)配1 mol·L-1的稀盐酸 100 mL,配制过程所用仪器,且使用先后顺序正确的是
①100 mL量筒 ②10 mL量筒 ③50 mL 烧杯 ④电子天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒
A.①③⑤⑥⑦
B.②③⑦⑤⑥
C.③⑤⑦⑥①
D.④③⑦⑤⑥
参考答案:B
本题解析:设浓盐酸的体积为Vml,则Vml×1.2g?cm-3×36.5%=1mol?L-1×0.1L×36.5g/mol,解得:V=8.33ml,所以量取时用10mL量筒,配制顺序是:计算→量取→稀释、冷却→移液→洗涤→定容→摇匀→装瓶贴签,一般用量筒(用到胶头滴管)量取,在烧杯中稀释,冷却后转移到100mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀。所以需要的仪器先后为:量筒、胶头滴管、烧杯、玻璃棒、100mL容量瓶,故选:B。
考点:考查一定物质的量浓度溶液的计算与仪器
本题难度:一般
3、选择题 用NA表示阿伏加德罗常数的值。下列叙述正确的是(?)
A.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
B.1 mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒
C.1 mol H2O2在MnO2作催化剂的条件下完全分解生成O2,转移电子数为2NA
D.1 mol Na2O2中含有的阴离子数目为2NA
参考答案:A
本题解析:略
本题难度:简单
4、选择题 下列实验操作会引起测定或配制结果一定偏高的是
[? ]
参考答案:D
本题解析:
本题难度:一般
5、选择题 标准状况下,①6.72L NH3?②1.204×1023个 H2S?③5.6g CH4?④0.5mol HCl ,下列关系正确的是(?)
A.体积大小:④>③>②>①
B.原子数目:③>①>④>②
C.密度大小:④>②>③>①
D.质量大小:④>③>②>①
参考答案:B
本题解析:略
本题难度:简单