时间:2020-08-13 05:07:31
1、选择题 下列各栏对应关系全部正确的是
A.A
B.B
C.C
D.D
参考答案:D
本题解析:分析:A、纯碱的主要成分为Na2CO3,属于盐类;
B、小苏打的主要成分为NaHCO3,属于盐类;
C、磁铁矿的主要成分为Fe3O4,属于金属氧化物;
D、铝土矿的主要成分为Al2O3,属于两性氧化物;
解答:A、因纯碱的主要成分为Na2CO3,属于盐类,故A错误;
B、因小苏打的主要成分为NaHCO3,属于盐类,故B错误;
C、因磁铁矿的主要成分为Fe3O4,属于金属氧化物,故C错误;
D、根据铝土矿的主要成分为Al2O3,属于两性氧化物,故D正确;
故选:D.
点评:本题主要考查了俗称、主要成分化学式以及类别的关系,难度不大,可根据课本知识回答.
本题难度:简单
2、填空题 下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题: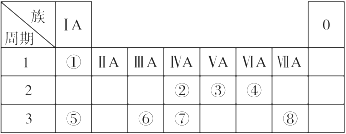
(1)在以上元素的原子中,原子半径最大的是?(填元素符号)。
(2)地壳中含量居于第二位的元素在周期表中的位置是?。
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式?、?。
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是?。
A.最高正化合价为+6价
B.气态氢化物比H2S稳定
C.最高价氧化物的水化物的酸性比硫酸弱
D.单质在常温下可与氢气化合
(5)由元素⑥、⑧形成的物质X与由元素①、③形成的化合物Y可发生以下反应: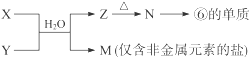
X溶液与Y溶液反应的离子方程式?,?
M中阳离子的鉴定方法?。
参考答案:(1)Na (2)第三周期第ⅣA族
(3)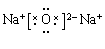 、
、 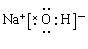 ;
;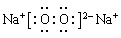 (4) B D
(4) B D
(5)Al3++3NH3·H2O=Al(OH)3↓+3NH4+(或Al3++3NH3+3H2O=Al(OH)3↓+3NH4+)
取少量M样品放入试管,加入氢氧化钠溶液后加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子。
本题解析:(1)对于电子层数相同的元素来说,原子序数越大,原子半径越小;对于电子层数不同的元素来说,原子核外的电子层数越多,原子半径越大。所以在题目已知的元素中,原子半径最大的是Na. (2)地壳中含量居于第二位的元素Si在周期表中的位置是第三周期第ⅣA族。(3)①是H;④是O;⑤是Na.在这三种元素中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式为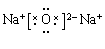 ;
;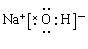 ;
;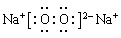 。(4)第四周期第ⅥA的元素是Se,A.由于原子的最外层有6个电子,所以最高化合价为+6价;正确。B.同族元素从上到下,元素的非金属性逐渐减弱,所以气态氢化物的稳定性逐渐减弱。因此气态氢化物H2Se比H2S稳定差。错误。C.元素的非金属性越强,其最高价氧化物的水化物的酸性也越强。由于元素的非金属性S>Se。所以酸性H2SeO4比硫酸弱。正确。D.由于活动性S>Se,所以单质在常温下不能与氢气化合。错误。选项为BD。(5)由元素⑥、⑧形成的物质AlCl3与由元素①、③形成的化合物NH3在水中发生的反应为Al3++3NH3·H2O=Al(OH)3↓+3NH4+。M为NH4Cl。检验NH4+的方法是取少量M样品放入试管,加入氢氧化钠溶液后加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子。
。(4)第四周期第ⅥA的元素是Se,A.由于原子的最外层有6个电子,所以最高化合价为+6价;正确。B.同族元素从上到下,元素的非金属性逐渐减弱,所以气态氢化物的稳定性逐渐减弱。因此气态氢化物H2Se比H2S稳定差。错误。C.元素的非金属性越强,其最高价氧化物的水化物的酸性也越强。由于元素的非金属性S>Se。所以酸性H2SeO4比硫酸弱。正确。D.由于活动性S>Se,所以单质在常温下不能与氢气化合。错误。选项为BD。(5)由元素⑥、⑧形成的物质AlCl3与由元素①、③形成的化合物NH3在水中发生的反应为Al3++3NH3·H2O=Al(OH)3↓+3NH4+。M为NH4Cl。检验NH4+的方法是取少量M样品放入试管,加入氢氧化钠溶液后加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子。
本题难度:一般
3、选择题 若某一个原子在处于能量最低状态时,外围电子排布为4d15s2,则下列各项说法正确的是
A.该元素原子最外层共有3个电子
B.该元素位于第5周期ⅡA族
C.该元素原子核外第N层上共有9个不同状态的电子
D.该元素原子第四电子层上有5个空轨道
参考答案:C
本题解析:某原子在处于能量最低状态时,外围电子排布为4d15s2,应为Y元素,位于周期表第五周期第ⅢB族,第N层的电子排布为4s24p64d1,以此解答该题。A、该元素原子最外层为5s2,有2个电子,故A错误;B、为Y元素,位于第五周期第ⅢB族,故B错误;C、第N层的电子排布为4s24p64d1,有9个不同状态的电子,故C正确;D、4d能级上有1个电子,则该元素原子第四电子层上有4个空轨道,故D错误,因此答案选C。
本题难度:一般
4、填空题 36 g H2O与80 g D2O的物质的量之比是_ _____,分子中所含质子数之比是________,所含中子数之比是____?___,它们分别与Na反应时,所放出气体体积之比(同条件下)是________,质量之比是________。(10分)
参考答案:1:2? 2:5? 1:2? 1:4
本题解析:略
本题难度:简单
5、选择题 在短周期中的X和Y两种元素可组成化合物XY3,说法正确的是?(?)
A.X和Y一定不属于同一主族
B.X和Y可属于同一周期,也可属于两个不同周期
C.XY3一定是共价化合物
D.XY3一定是离子化合物
参考答案:B
本题解析:略
本题难度:简单