时间:2020-08-13 04:56:10
1、选择题 已知下列热化学方程式:H2(g)+1/2O2(g)="=" H2O(l) △H= -285.8kJ/mol,
H2(g)+1/2O2(g)="=" H2O(g) △H= -241.8kJ/mol则氢气的标准燃烧热是
A.-285.8kJ/mol
B.285.8kJ/mol
C.-241.8kJ/mol
D.241.8kJ/mol
参考答案:A
本题解析:燃烧热是指在一定条件下,1mol可燃物燃烧生成稳定氧化物时放出的热量,选A。
考点:考查燃烧热的定义。
本题难度:一般
2、填空题 (8分)(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4的燃烧热化学方程式是 。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。
肼—空气燃料电池放电时:负极的电极反应式是 。
(3)电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42- 2PbSO4+2H2O,充电时:阳极反应式: 用此装置电解水和重水(D2O)组成的混合液(两电极均是Pt),通电一段时间后,在两极共收集到33.6 L(标准状况)气体,总质量为18.5 g,则混合气体中H原子和D原子个数之比:
2PbSO4+2H2O,充电时:阳极反应式: 用此装置电解水和重水(D2O)组成的混合液(两电极均是Pt),通电一段时间后,在两极共收集到33.6 L(标准状况)气体,总质量为18.5 g,则混合气体中H原子和D原子个数之比:
参考答案:(1)N2H4(1)+O2(g)=N2(g)+2H2O(1);△H=-624kJ/mol;(2)N2H4+4OH--4e-=4H2O+N2↑
(3)PbSO4-2e-+2H2O==PbO2+SO42-+4H+ 3∶1
本题解析: (1)燃烧热是1mol的物质完全燃烧产生稳定的氧化物时所放出的热量。32.0gN2H4的物质的量就是1mol,所以N2H4的燃烧热化学方程式是N2H4(1)+O2(g)=N2(g)+2H2O(1);△H=-624kJ/mol;(20在燃料电池中,通入燃料的电极是负极,根据题意,在碱性环境中,负极的电极反应式是N2H4+4OH--4e-=4H2O+N2↑;(3)电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42- 2PbSO4+2H2O,[充电时:阳极发生氧化反应,该电极的电极反应式PbSO4-2e-+2H2O==PbO2+SO42-+4H+; (4)电解水的方程式是2H2O
2PbSO4+2H2O,[充电时:阳极发生氧化反应,该电极的电极反应式PbSO4-2e-+2H2O==PbO2+SO42-+4H+; (4)电解水的方程式是2H2O 2H2↑+O2↑。n(气体)=33.6 L÷22.4L/mol=1.5mol,则产生氧气0. 5mol,其质量16g,产生氢气1mol,质量是2.5 g.即1mol的H原子,质量是1.25 g,根据十字交叉法可得H:D=3:1。
2H2↑+O2↑。n(气体)=33.6 L÷22.4L/mol=1.5mol,则产生氧气0. 5mol,其质量16g,产生氢气1mol,质量是2.5 g.即1mol的H原子,质量是1.25 g,根据十字交叉法可得H:D=3:1。
考点:考查燃烧热的化学方程式的书写、燃料电池、铅蓄电池电极反应式的书写及电解原理的计算的知识。
本题难度:一般
3、选择题 下列热化学方程式表达正确的是(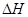 的绝对值均正确)
的绝对值均正确)
A.C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g)△H="
参考答案:
本题解析:
本题难度:一般
4、选择题 常温时,以下4种溶液pH最大的是
A.0.01 mol·L-1氨水溶液
B.0.02 mol·L-1氨水与0.02 mol·L-1盐酸溶液等体积混合液
C.0.03 mol·L-1氨水与0.01 mol·L-1盐酸溶液等体积混合液
D.pH=2的盐酸与pH=12的Ba(OH)2溶液等体积混合液
参考答案:A
本题解析:
正确答案:A
B、实为0.01mol/LNH4Cl;C、实为0.01 mol·L-1氨水溶液0.005mol/LNH4Cl;D、为BaCl2溶液,pH由大到小的顺序为:A、C、B、D,故A正确。
本题难度:一般
5、选择题 下列热化学方程式中△H代表燃烧热的是
[? ]
A.CH4(g) + 3/2O2(g) = 2H2O(l) + CO(g) △H1
B.S(s) + 3/2O2(g) = SO3(s) △H2
C.C6H12O6(s) + 6O2(g) = 6CO2(g) + 6H2O(l)△H3
D.2CO(g) + O2(g) = 2CO2(g) △H4
参考答案:C
本题解析:
本题难度:简单