时间:2020-08-13 04:51:42
1、实验题 (6分)填空题:
(1)(2分)下列实验操作不正确的是?(填字母代号)。
A.在催化剂存在的条件下,苯和溴水发生反应可生成无色、比水重的液体溴苯。
B.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,完成乙醇氧化为乙醛的实验。
C.醇中含有少量水可加入生石灰再蒸馏制得无水乙醇。
D.有朝一日宇航员乘坐“嫦娥”遨游月空时,在其轨道舱中无法完成“粗盐的提纯”实验
E.实验室制取乙烯时,放入几片碎瓷片,以避免混合液在受热沸腾时剧烈跳动。
F.验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合,充分振荡溶液、静置、待液体分层后,滴加硝酸银溶液。
G.实验室蒸馏石油时温度计水银球插入石油中测量温度,收集60℃~150℃馏分得到汽油。
(2)(2分)? 的单体为___________?
的单体为___________?
维通橡胶是一种耐腐蚀、耐油、耐高潮、耐寒性能都特别好的氟橡胶。它的结构简式为: ?合成它的单体为________________________
?合成它的单体为________________________
参考答案:(1) AFG (选不全1分,有错不得分)(2)NH2-(CH2)nNH2? HOOC(CH2)mCOOH
CF2=CH2? CF2=CF2CF3
本题解析:(1)苯与液溴在铁做催化剂时反应,故A错误;B为乙醇的催化氧化,正确;C加入生石灰吸收水,再将低沸点的乙醇蒸出,正确;D在太空中,无地心引力,故正确;F应将反应后的溶液加硝酸酸化后,再加硝酸银溶液,以排除OH-对检验的干扰;G实验室蒸馏石油时温度计水银球应位于蒸馏烧瓶的支管口处
本题难度:简单
2、填空题 (14分)
由短周期元素组成的化合物X是某抗酸药的有效成分。甲同学欲探究X的组成。
查阅资料:①由短周期元素组成的抗酸药的有效成分有碳酸氢钠、碳酸镁、氢氧化铝、硅酸镁铝、磷酸铝、碱式碳酸镁铝。
②Al3+在pH=5.0时沉淀完全;
Mg2+在pH=8.8时开始沉淀,在pH=11.4时沉淀完全。
实验过程:
Ⅰ.向化合物X粉末中加入过量盐酸,产生气体A,得到无色溶液。
Ⅱ.用铂丝蘸取少量I中所得的溶液,在火焰上灼烧,无黄色火焰。
Ⅲ.向I中所得的溶液中滴加氨水,调节pH至5~6,产生白色沉淀B,过滤。
Ⅳ.向沉淀B中加过量NaOH溶液,沉淀全部溶解。
Ⅴ.向Ⅲ中得到的滤液中滴加NaOH溶液,调节pH至12,得到白色沉淀C。
(1)?Ⅰ中气体A可使澄清石灰水变浑浊,A的化学式是__________。
(2)?由Ⅰ、Ⅱ判断X一定不含有的元素是磷、_____________。
(3)?Ⅲ中生成B的离子方程式是_____________。
(4)?Ⅳ中B溶解的离子方程式是_____________。
(5)?沉淀C的化学式是_____________。
(6)?若上述n(A):n(B):n(C)=1:2:3,则X的化学式是_____________。
参考答案:⑴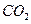
⑵钠?硅
⑶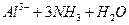

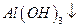 +
+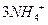
⑷

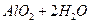
⑸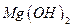
⑹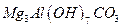
本题解析:略
本题难度:一般
3、实验题 (13分)茶是我国人民喜爱的饮品,其中含有多种有益于人体健康的成分,据测定茶叶中含有450种以上的有机成分与15种以上的元素.某化学研究小组欲探究茶叶中钙元素的含量,设计了探究实验方案如下:(已知茶叶中的铝、铁元素对钙离子的测定有影响)
步骤1:称取500 g干燥的茶叶,置于通风橱中,充分灼烧使茶叶灰化,再用研钵磨细后移入烧杯中,然后将200mL 1 mol·L-1盐酸加入灰中搅拌、过滤、洗涤.
步骤2:向步骤1所得滤液中逐滴加入稀氢氧化钠溶液,调节溶液的pH为6~7左右,使铝、铁的氢氧化物完全沉淀,再加热煮沸30 min,加入7.95 g无水碳酸钠,充分搅拌,待沉淀完全后,过滤,洗涤,过滤后得到滤液和沉淀.
步骤3:将步骤2所得的滤液稀释至500 mL,取其中的20.00 mL溶液以甲基橙作指示剂,用0.1000 mol·L-1的HCl标准溶液滴定,终点时消耗盐酸的体积为20.00 mL,计算结果.请回答下列问题:
步骤 1中:使茶叶灰化需要三角架、泥三角、酒精喷灯、_________、_________等仪 器.
器.
步骤2中:改用试剂________________来调节pH将更为方便.判断沉淀已经洗涤干净的方法是______________________________________________________________.
步骤3中:原茶叶中钙离子的质量分数为________________.若碳酸钠试剂不纯,且所含杂质不与Ca2+反应,则测得的钙离子的质量分数将__________(填下列序号之一:①偏小?②偏大?③不偏?④偏小或偏大或不偏)
参考答案:
步骤1:坩埚、坩埚钳
步骤2:氨水?取最后一次洗涤液少许于试管中,滴加CaCl2溶液, 若无沉淀产生,则已洗净.(其他合理答案均给分)
若无沉淀产生,则已洗净.(其他合理答案均给分)
步骤3: 0.4%(或0.004)? ④
本题解析:略
本题难度:简单
4、实验题 为了验证浓度对硫酸氧化性的影响,某同学根据题目提示,选择下列仪器(仪器可以多次使用)设计实验,验证Zn+ H2SO4(稀)=ZnSO4 +H2↑;Zn +2H2SO4(浓) ZnSO4+SO2↑+2H2O,供选用的药品为18 mol/L硫酸溶液、锌粒、品红试液、溴水、酸性高锰酸钾溶液、浓硫酸、氧化铜、无水硫酸铜、碱石灰。提示:①二氧化硫具有还原性,可能与氧化铜反应;②E、F装置都使用;③同一装置可多次使用。
ZnSO4+SO2↑+2H2O,供选用的药品为18 mol/L硫酸溶液、锌粒、品红试液、溴水、酸性高锰酸钾溶液、浓硫酸、氧化铜、无水硫酸铜、碱石灰。提示:①二氧化硫具有还原性,可能与氧化铜反应;②E、F装置都使用;③同一装置可多次使用。 
(1)组合装置气流从左至右,接口连接顺序为___。
(2)D装置发生反应的离子方程式为____; C装置发生反应的化学方程式为____。
(3)E装置中药品是碱石灰,F装置中应装入____,其作用是____。
(4)证明锌与浓硫酸反应有二氧化硫产生的现象是 ____;锌与稀硫酸反应产生氢气的现象是________。
(5)简述锌与浓硫酸反应开始不产生氢气的原因是____。
参考答案:(1)b→l→k→e→f→l→k→g→b→c→d(d→c) i→j (j→i)
(2)SO2+2H2O+Br2=SO42- +2Br-+4H+? ;CuO+H2 Cu+H2O
Cu+H2O
(3)无水硫酸铜 ;检验产物水
(4)气体开始通入品红试液时,品红褪色 ;C中黑色粉末变红色,F中无水硫酸铜由白色变成蓝色
(5)浓硫酸溶液中主要含有H2SO4分子,H+很少;且+6价硫的氧化性强于H+的氧化性
本题解析:
本题难度:困难
5、简答题 一天,小明走进实验室,看到了一幅“不和谐”的画面(如图).围绕此瓶试剂是否变质的问题,展开了探究.
(1)小明提出下列猜想:
猜想一:如果试剂完全变质,则溶液中溶质是______;
猜想二:如果试剂部分变质,则溶液中溶质是NaOH和Na2CO3;
猜想三:如果试剂没有变质,则溶液中溶质是NaOH.
(2)写出NaOH发生变质的化学反应方程式:______.
(3)请你设计实验证实该试剂已经部分变质,完成探究方案:
| 实验步骤 | 预期现象及结论 |
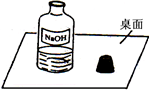
参考答案:(1)观察图,氢氧化钠溶液敞口放置时能与空气中二氧化碳直接接触,氢氧化钠溶液吸收二氧化碳生成碳酸钠和水而变质;全部变质,溶液中溶质为:Na2CO3(或碳酸钠);
故答案为:Na2CO3(或碳酸钠);
(2)图中盛放氢氧化钠溶液的试剂瓶敞口放置,氢氧化钠吸收空气中的二氧化碳生成碳酸钠而变质;
故答案为:CO2+2NaOH=Na2CO3+H2O;
(3)试剂部分变质需要检验溶液中含有碳酸钠和氢氧化钠; 取试剂少许加入足量氯化钡生成白色沉淀证明含有碳酸钠,静止后向上层溶液中滴加酚酞试液,溶液变红证明含有氢氧化钠;
故答案为:
实验操作实验现象及结论取少量待测液于试管,加入足量BaCl2溶液产生白色沉淀,则说明溶液中含有Na2CO3向静置后的上述试管中,滴加少量酚酞溶液溶液变红(1分),则说明溶液中含有NaOH
本题解析:
本题难度:一般