时间:2020-08-13 04:49:18
1、选择题 下列说法正确的是? (? )
A.10电子的离子对H2O的电离平衡均能产生影响
B.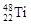 与
与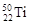 两种核素均是周期表第四周期主族元素
两种核素均是周期表第四周期主族元素
C.IA族元素的原子半径比ⅦA族元素的原子半径大
D.原子序数相差8的两种短周期元素,其周期序数相差1
参考答案:D
本题解析:A错,如钠离子,对H2O的电离平衡无影响;B错,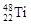 与
与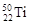 两种核素均是周期表第四周期副族元素;C错,同周期IA族元素的原子半径比ⅦA族元素的原子半径大;D正确,原子序数相差8的两种短周期元素,其周期序数相差1
两种核素均是周期表第四周期副族元素;C错,同周期IA族元素的原子半径比ⅦA族元素的原子半径大;D正确,原子序数相差8的两种短周期元素,其周期序数相差1
本题难度:一般
2、选择题 下列说法正确的是
A.0.1mol/LCH3COOH溶液加水稀释,溶液中c(OH-)增大
B.将NaOH和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的1/2
C.相同浓度的HCl和CH3COOH,两溶液中c(H+)相同
D.甲溶液的pH是5,乙溶液的pH是4,则甲溶液与乙溶液的c(H+)之比为10:1
参考答案:A
本题解析:略
本题难度:简单
3、选择题 已知在101 kPa下,1 g氢气在氧气中完全燃烧生成气态水时,放出热量120.9 kJ.则下列说法中正确的是( )
A.氢气的燃烧热为241.8 kJ/mol
B.1 mol H2O(l)具有的能量大于1 mol H2O(g)具有的能量
C.反应的热化学方程式为:2H2(g)+O2(g)===2H2O(g);ΔH=+483.6 kJ/mol
D.2 mol H2(g)和1 mol O2(g)具有的能量总和大于2 mol H2O(g)具有的能量
参考答案:D
本题解析:燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,A不正确,水的稳定产物是液态;1 g氢气在氧气中完全燃烧生成气态水时,放出热量120.9 kJ,所以1mol氢气完全生成气态水时放出的热量是120.9 kJ×2=241.8 kJ。该反应是放热反应,这说明2 mol H2(g)和1 mol O2(g)具有的能量总和大于2 mol H2O(g)具有的能量,D正确,选项BC不正确,答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养,旨在培养学生分析、归纳、总结问题的能力,有利于培养学生的逻辑思维能力和应试能力。
本题难度:一般
4、选择题 某酸溶液的pH=3,则该酸溶液的物质的量浓度为( )
A.一定大于0.001 mol·L-1
B.一定等于0.001 mol·L-1
C.一定小于0.001 mol·L-1
D.以上说法均欠妥
参考答案:D
本题解析:pH=3,c(H+)="0.001" mol·L-1。
该酸为一元强酸时,则c(酸)="0.001" mol·L-1,该酸为多元强酸时,则c(酸)<0.001 mol·L-1,该酸为弱酸时,则c(酸)>0.001 mol·L-1。
本题难度:一般
5、选择题 向20 mL 0.5 mol·L-1的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法中错误的是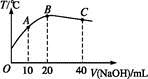
A.醋酸的电离平衡常数:B点>A点
B.由水电离出的c(OH-):B点>C点
C.从A点到B点,混合溶液中可能存在:c(CH3COO-)=c(Na+)
D.从B点到C点,混合溶液中一直存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
参考答案:D
本题解析:中和反应是放热反应,在B点时恰好完全反应,B点为CH3COONa溶液,溶液显碱性,水的电离程度最大,溶液温度最高时醋酸的电离平衡常数最大,A、B选项正确;从A点到B点混合溶液可能显中性,依据电荷守恒可知C选项正确;在C点时为等浓度的CH3COONa、NaOH混合溶液,c(OH-)>c(CH3COO-),D选项错误。
本题难度:一般