时间:2020-08-13 04:42:45
1、选择题 A、B、C、D分别为固体氧化物燃料电池、碱性燃料电池、质子交换膜燃料电池、熔融盐燃料电池,其中正极的反应产物为水的是
( )
A.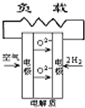
B.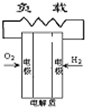
C.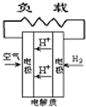
D.
参考答案:A.在固体氧化物燃料电池中,正极上O2+4e-=2O2-,故A不选;
B.碱性燃料电池中,正极上发生O2+2H20+4e-=4OH-,故B不选;
C.质子交换膜燃料电池,正极上发生4H++O2+4e-=2H20,故C选;
D.熔融盐燃料电池中,2CO2+O2+4e-=2CO32-,故D不选;
故选C.
本题解析:
本题难度:简单
2、填空题 尿素(H2NCONH2)是有机态氮肥,在农业生产中有着非常重要的作用。
(1)工业上合成尿素的反应分两步进行:
第一步:2NH3(l)+CO2 H2NCOONH4(氨基甲酸铵)(l) △H1
H2NCOONH4(氨基甲酸铵)(l) △H1
第二步:H2NCOONH4 (l)  H2O+ H2NCONH2(l)△H2
H2O+ H2NCONH2(l)△H2
某化学学习小组模拟工业上合成尿素的条件,在体积为1 L的密闭容器中投入4 mol NH3和1 mol CO2,实验测得反应中各组分的物质的量随时间的变化如下图I所示。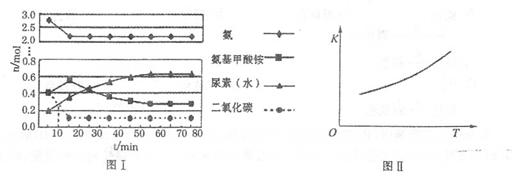
①已知总反应的快慢是由较慢的一步反应决定的。则合成尿素总反应的快慢由第______步反应决定,总反应进行到______min时到达平衡。
②第二步反应的平衡常数K随温度的变化如上右图II所示,则ΔH2______0(填“>”、“<”或“=”。)
(2)该小组将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡: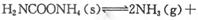
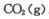 。实验测得不同温度下的平衡数据列于下表:
。实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/Kpa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/10-3mol/L | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
参考答案:(1)① 二(2分) 55 (2分)?②>(2分)
(2)①BC(2分)?②?1.6×10-8 mol3·L-3(2分)
(3)?-1627.2 kJ·mol-1(2分)
(4)CO(NH2)2 + H2O - 6e-?= CO2↑+ N2↑+ 6H+(2分)
本题解析:(1)①总反应的快慢是由较慢的一步反应决定的,由图像看到随着时间的递增,尿素慢慢增加;
所以第二步决定,在55min时,尿素量不再增加,到达平衡。②对于吸热反应,随着温度的升高,K增大,所以ΔH2>0.
(2)①A、2V(NH3)=V(CO2)不符合速率之比等于方程式系数之比,错误。B中当物质的量不再发生变化时,压强也不变化,正确;C中氨基甲酸铵是固体,当它不再分解时,气体质量不再增加,密闭容器体积一定,密度不再改变,达到平衡,正确;D中氨气和CO2的比例一直不变,错误,答案是BC
②根据表中数据, 25.? 0°C,气体总浓度是4.8×10-3,,氨气和CO2体积比为1:2,结合平衡常数公式计算可得结果为1.6×10-8 mol3·L-3
(3)根据盖斯定律知,△H= -2△H1-2△H2+3△H3,代入数据计算既得结果?-1627.2 kJ·mol-1
(4)CO(NH2)2 + H2O - 6e-?= CO2↑+ N2↑+ 6H+
本题难度:一般
3、选择题 下列装置能构成原电池的是
[? ]
A.
B.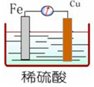
C.
D.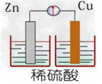
参考答案:B
本题解析:
本题难度:简单
4、选择题 一学生欲通过实验判断X,Y,Z,W四块金属的活泼性,做了如下实验并得结论:当X,Y组成原电池时,Y为负极;当Z,W组成原电池时,W为正极;W能将Y从其盐溶液中置换出来,据此可知它们的活泼性顺序是( )
A.Z>W>X>Y
B.X>Y>Z>W
C.X>Y>W>Z
D.Z>W>Y>X
参考答案:当X,Y组成原电池时,Y为负极,说明活泼性Y>X,当Z,W组成原电池时,W为正极,说明Z做原电池的负极,所以活泼性Z>W,W能将Y从其盐溶液中置换出来,说明活泼性W>Y,综上可知金属的活泼性顺序是Z>W>Y>X.
故选D.
本题解析:
本题难度:一般
5、选择题 固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是 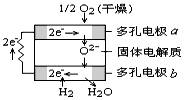
[? ]
A.有O2放电的a极为电池的负极
B.有H2放电的b极为电池的正极
C.a极对应的电极反应为:O2 + 2H2O + 4e- = 4OH-
D.该电池的总反应方程式为:2H2 + O2 =2H2O
参考答案:D
本题解析:
本题难度:一般