时间:2020-08-13 04:42:45
1、填空题 我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
I.已知反应  Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)
 Fe(s)+ CO2(g) ΔH=-23.5 kJ·mol-1,该反应在
Fe(s)+ CO2(g) ΔH=-23.5 kJ·mol-1,该反应在
1000℃的平衡常数等于4。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1. 0mol,反应经过l0min后达到平衡。
(1)CO的平衡转化率=____________
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+ 2H2(g) CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=________
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡
2、选择题 依据原电池原理,设计番茄电池并检测电流的产生,其中合理的是
A.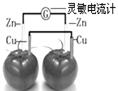
B.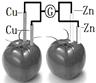
C.
D.
3、填空题 (13分)由方铅矿(PbS)制备Pb和PbO2的方法如下: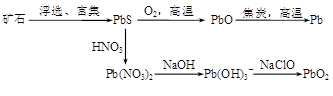
PbO与焦炭煅烧时可能会发生如下反应:
PbO(s)+C(s)=Pb(s)+CO(g)? ΔH=+108.5 kJ·mol—1? ①
PbO(s)+CO(g)=Pb(s)+CO2(g)? ΔH=-64 kJ·mol—1? ②
(1)已知Pb与O2反应的热化学方程式为:2Pb(s)+O2(g)=2PbO(s)? ΔH=-438 kJ·mol—1
则C完全燃烧的热化学方程式为?。
(2)能提高反应②中PbO转化率的措施有?(填字母)。
a.升高温度? b.增大压强? c.加入焦炭? d.加入催化剂
(3)制备过程中会产生SO2、NO、CO等有毒气体,可将它们按一定比例混合在一定条件下反应得到S、N2和CO2。若SO2与NO的体积比为1∶2,该反应的化学方程式为?。
(4)水溶液中铅的存在形态有多种,各形态的浓度分数α随溶液pH变化的关系如下图所示: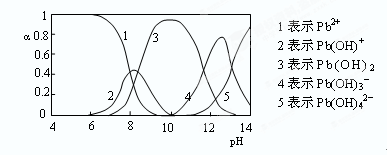
pH=6.5时,Pb2+水解的离子方程式为?;加入NaClO制备PbO2之前需先用NaOH调节溶液pH至12.5,理由是?。
4、选择题 下列各组排列顺序中正确的是: ?
?

A.微粒半径: K+>Cl->S2->Na+
B.稳定性:HI> HBr>HCl>HF
C.酸性: HClO4>H2SO4>H3PO4>H4SiO4
D.熔点:金刚石>NaCl>SiO2>Na
5、填空题 海水中蕴藏着丰富的资源.海水综合利用的流程图如图1.
(1)为检验精盐纯度,需配制250mL?0.2mol/L?NaCl(精盐)溶液,图2是该同学转移溶液的示意图,图中有两点错误请指出:______
(2)用NaCl做原料可以得到多种产品.
实验室用惰性电极电解100mL?0.1mol/LNaCl溶液,若阴阳两极均得到112mL气体(标准状况,假设气体物质全部从溶液中逸出),则所得溶液的pH为______(忽略反应前后溶液的体积变化).
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如图3所示,其中的电极未标出,所用的离子膜都只允许阳离子通过.
①图中X、Y分别是______、______(填化学式),②写出燃料电池B中正极发生的电极反应______;
(4)图4欲实现Cu+H2SO4═CuSO4+H2,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”).